
【題目】(1)已知Ksp(AgCl)=1.8×10-10,則將AgCl放在蒸餾水中形成飽和溶液,溶液中的c(Ag+)是________?
(2)已知Ksp[Mg(OH)2]=1.8×10-11,則將Mg(OH)2放入蒸餾水中形成飽和溶液,溶液的pH為________?
(3)在0.01 mol·L-1的MgCl2溶液中,逐滴加入NaOH溶液,剛好出現沉淀時,溶液的pH是________?當Mg2+完全沉淀時,溶液的pH為________?
【答案】1.3×10-5mol·L-1 10.5 9.6 11.1
【解析】
(1)由AgCl(s)Ag+(aq)+Cl-(aq)
知c(Ag+)=c(Cl-)
所以Ksp(AgCl)=1.8×10-10=c(Ag+)·c(Cl-)=c2(Ag+)
解得c(Ag+)=1.3×10-5mol·L-1,
故答案為:1.3×10-5mol·L-1;
(2)由Mg(OH)2(s)Mg2+(aq)+2OH-(aq)
知Ksp[Mg(OH)2]=1.8×10-11=c(Mg2+)·c2(OH-)=![]() ·c2(OH-)
·c2(OH-)
解得c(OH-)=3.3×10-4mol·L-1
所以c(H+)=![]() =3.0×10-11mol·L-1
=3.0×10-11mol·L-1
所以pH=10.5,
故答案為:10.5。
(3)由Ksp[Mg(OH)2]=1.8×10-11=c(Mg2+)·c2(OH-)=0.01·c2(OH-)
c(OH-)=4.2×10-5mol·L-1
c(H+)=![]() =2.4×10-10mol·L-1
=2.4×10-10mol·L-1
所以pH=9.6,即當pH=9.6時,開始出現Mg(OH)2沉淀。
由于一般認為殘留在溶液中的離子濃度小于1×10-5mol·L-1時,沉淀已經完全,故Mg2+完全沉淀時有:
1×10-5·c2(OH-)=1.8×10-11
所以c(OH-)=1.34×10-3mol·L-1
c(H+)=![]() =7.46×10-12mol·L-1
=7.46×10-12mol·L-1
所以pH=11.1,
故答案為:9.6;11.1。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】過氧化氫分解反應過程中,能量變化如圖所示:下列說法正確的是

A. 催化劑可以改變過氧化氫分解反應的焓變
B. CuCl2或FeCl3可以催化H2O2分解反應
C. 催化劑不能改變反應路徑
D. H2O2分解是吸熱反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表為元素周期表的一部分,表中列出11種元素在周期表中的位置,按要求回答下列各題:
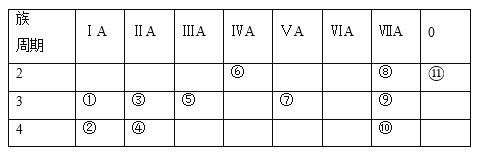
(1)這11種元素中,化學性質最不活潑的元素是______(填元素符號,下同),得電子能力最強的原子是______,失電子能力最強的單質與水反應的化學方程式__________。
(2)元素④的離子結構示意圖為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲醇可作為燃料電池的原料,以CH4和H2O為原料,通過下列反應來制備甲醇:
CH4(g)+H2O(g)═CO(g)+3H2(g) △H=+206.0kJmol-1
CO(g)+2H2(g)═CH3OH(g) △H=-129.0kJmol-1
(1)CH4(g)與H2O(g)反應生成CH3OH(g)和H2(g)的熱化學方程式為______。
(2)甲醇對水質會造成一定污染,有一種電化學法可消除這種污染,其原理是通電后,將Co2+氧化成Co3+,然后以Co3+作氧化劑把水中的甲醇氧化成CO2而凈化。實驗室用如圖裝置模擬上述過程:

①完成除去甲醇的離子方程式:______
Co3++CH3OH+H2O═Co2++……
②若如圖裝置中的電源為甲醇—空氣—KOH溶液的燃料電池,則電池負極的電極反應式:___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鋰離子電池的應用很廣,其正極材料可再生利用。某鋰離子電池正極材料有鈷酸鋰(LiCoO2)、導電劑乙炔黑和鋁箔等。充電時,該鋰離子電池負極發生的反應為6C+xLi++xe- = LixC6。現欲利用以下工藝流程回收正極材料中的某些金屬資源(部分條件未給出)。

回答下列問題:
(1)LiCoO2中,Co元素的化合價為 。
(2)寫出“正極堿浸”中發生反應的離子方程式 。
(3)“酸浸”一般在80℃下進行,寫出該步驟中發生的所有氧化還原反應的化學方程式 ;可用鹽酸代替H2SO4和H2O2的混合液,但缺點是 。
(4)寫出“沉鈷”過程中發生反應的化學方程式 。
(5)充放電過程中,發生LiCoO2與Li1-xCoO2之間的轉化,寫出放電時電池反應方程式 。
(6)上述工藝中,“放電處理”有利于鋰在正極的回收,其原因是 。在整個回收工藝中,可回收到的金屬化合物有 (填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】25℃時,一定量的Na2C03與鹽酸混合所得溶液中,部分含碳微粒的物質的量分數(![]() )與pH的關系如圖所示。下列說法正確的是
)與pH的關系如圖所示。下列說法正確的是

A. 曲線X表示的微粒為CO32-
B. pH=6.3時,![]() (CO32-)+
(CO32-)+![]() (HCO3-)+
(HCO3-)+![]() (H2CO3)=1.0
(H2CO3)=1.0
C. pH=7時,c(HCO3-)>c(CO32-)>c(H2CO3)>c(OH-)=c(H+)
D. pH=10.3 時,c(Na+)+c(H+)=c(Cl-)+c(OH-)+3c(HCO3-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關電解質溶液的說法正確的是( )
A.向0.1mol·L-1CH3COOH溶液中加入少量水,溶液中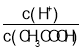 減小
減小
B.將CH3COONa溶液從20℃升溫至30℃,溶液中![]() 增大
增大
C.在pH=8的NaB溶液中:c(Na+)-c(B-)=9.9×10-8mol·L-1
D.向AgCl、AgBr的飽和溶液中加入少量AgNO3,溶液中![]() 不變
不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機化合物反應如下圖,據此回答下列問題:

(1)乙烯的結構式為:__________。
(2)寫出反應②③④的化學方程式:
②_________________________,反應類型:___________;
③_________________________,反應類型:___________;
④_________________________,反應類型:___________。
(3)實驗室常用下列裝置制取乙酸乙酯,請回答相關問題:

①濃硫酸的作用是_______________。
②飽和碳酸鈉溶液的主要作用是___________________。
③若要把制得的乙酸乙酯分離出來,應采用的操作是_________。
④進行該實驗時,最好向試管甲中加入幾塊碎瓷片,其目的是_____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PET(![]() ,M鏈節= 192 g·mol1)可用來生產合成纖維或塑料。測某PET樣品的端基中羧基的物質的量,計算其平均聚合度:以酚酞作指示劑,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至終點(現象與水溶液相同),消耗NaOH醇溶液v mL。下列說法不正確的是
,M鏈節= 192 g·mol1)可用來生產合成纖維或塑料。測某PET樣品的端基中羧基的物質的量,計算其平均聚合度:以酚酞作指示劑,用c mol·L1 NaOH醇溶液滴定m g PET端基中的羧基至終點(現象與水溶液相同),消耗NaOH醇溶液v mL。下列說法不正確的是
A.PET塑料是一種可降解高分子材料
B.滴定終點時,溶液變為淺紅色
C.合成PET的一種單體是乙醇的同系物
D.PET的平均聚合度![]() (忽略端基的摩爾質量)
(忽略端基的摩爾質量)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com