
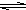 HS-+OH-
HS-+OH-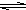 HS-+OH-
HS-+OH-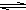 Al(OH)3+3H+有無色氣體和白色絮狀沉淀產生
Al(OH)3+3H+有無色氣體和白色絮狀沉淀產生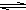 Al(OH)3+3H+有無色氣體和白色絮狀沉淀產生
Al(OH)3+3H+有無色氣體和白色絮狀沉淀產生| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
| 1 |
| 2 |
 HS-+OH-;NaOH;
HS-+OH-;NaOH; Al(OH)3+3H+,
Al(OH)3+3H+, Al(OH)3+3H+;有無色氣體和白色絮狀沉淀產生 3HCO3-+Al3+=Al(OH)3↓+CO2↑;
Al(OH)3+3H+;有無色氣體和白色絮狀沉淀產生 3HCO3-+Al3+=Al(OH)3↓+CO2↑;

 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
 汽車尾氣(含烴類、CO、NO與SO2等)是城市主要污染源之一,治理的辦法之一是在汽車排氣管上裝催化轉化器,它使NO與CO反應生成可參與大氣生態循環的無毒氣體,反應原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).
汽車尾氣(含烴類、CO、NO與SO2等)是城市主要污染源之一,治理的辦法之一是在汽車排氣管上裝催化轉化器,它使NO與CO反應生成可參與大氣生態循環的無毒氣體,反應原理:2NO(g)+2CO(g)═N2(g)+2CO2(g),在298K、100kPa下,△H=-113kJ/mol,△S=-145J/(mol?K).查看答案和解析>>
科目:高中化學 來源: 題型:

 Fe(SCN)2+來檢驗反應是否產生鐵離子.已知在一定溫度下該反應達到平衡時c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.則此溫度下該反應的平衡常數K=
Fe(SCN)2+來檢驗反應是否產生鐵離子.已知在一定溫度下該反應達到平衡時c(Fe3+)=0.04mol?L-1,c(SCN-)=0.1mol?L-1,c[Fe(SCN)2+]=0.68mol?L-1.則此溫度下該反應的平衡常數K=查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| Cu2O |
| 時間/min | 20 | 40 | 60 | 80 |
| n(O2)/mol | 0.0010 | 0.0016 | 0.0020 | 0.0020 |

查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)在一容積為2 L的密閉容器中,加入0.2 mol的N2和0.6 mol的H2,在一定條件下發生反應:N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0
2NH3(g) ΔH<0
反應中NH3的物質的量濃度的變化情況如下圖所示,請回答下列問題:
(1)根據上圖,計算從反應開始到平衡時,平均反應速率v(NH3)為______________.
(2)該反應達到平衡時H2的轉化率________.
(3)反應達到平衡后,第5分鐘末,保持其它條件不變,若改變反應溫度,達到新平衡時NH3的物質的量濃度不可能為____________.(填序號)
A、0.20 mol·L-1 b、0.12 mol·L-1 c、0.10 mol·L-1 d、0.08 mol·L-1
(4)在第5分鐘末將容器的體積縮小一半后,若在第8分鐘末達到新的平衡(此時NH3的濃度約為0.25 mol·L-1),請在上圖中畫出第5分鐘末到此平衡時NH3濃度的變化曲線.
(5)如果上述反應在相同溫度和容器中進行,欲使反應達到平衡時NH3的物質的量分數與原平衡相等,起始加入的三種物質的物質的量n(N2)、n(H2)、n(NH3)分別為a、b、c,則a、b、c之間應該滿足的關系式為:
(6)若該反應在298K、398K時的化學平衡常數分別為K1、K2,則K1 K2(填“>” “=” 或 “<” )。
查看答案和解析>>
科目:高中化學 來源:2012-2013學年黑龍江省牡丹江一中高二上學期期末化學試卷(帶解析) 題型:填空題
(12分)在一容積為2 L的密閉容器中,加入0.2 mol的N2和0.6 mol的H2,在一定條件下發生反應:N2(g)+3H2(g) 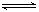 2NH3(g) ΔH<0 。反應中NH3的物質的量濃度的變化情況如下圖所示,請回答下列問題:
2NH3(g) ΔH<0 。反應中NH3的物質的量濃度的變化情況如下圖所示,請回答下列問題: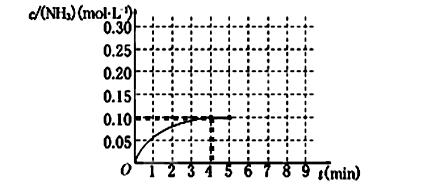
(1)根據上圖,計算從反應開始到平衡時,氫氣的平均反應速率v(H2)為______________。
(2)該反應達到平衡時N2的轉化率_________________。
(3)反應達到平衡后,第5分鐘末,保持其它條件不變,若改變反應溫度,則NH3的物質的量濃度不可能為____________。(填序號)
a.0.20 mol·L-1 b.0.12 mol·L-1 c.0.10 mol·L-1 d.0.08 mol·L-1
(4)請寫出該反應的平衡常數表達式_________,若該反應在298K、398K時的化學平衡常數分別為K1、K2,則K1 K2(填“>”、“="”" 或 “<” )。
(5)在第5分鐘末將容器的體積縮小一半后,若在第8分鐘末達到新的平衡(此時NH3的濃度約為0.25 mol·L-1),請在上圖中畫出第5分鐘末到此平衡時NH3濃度的變化曲線。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com