
【題目】A、B、C、D、E、F是原子序數依次增大的短周期主族元素。E是同周期元素金屬性最強的元素。甲、乙、丙、丁、戊是由上述部分元素中的兩種或幾種組成的化合物,它們的轉化關系如圖所示。其中甲是生活中的調味品,丁是淡黃色固體。下列說法不正確的是
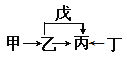
A. 原子半徑由大到小的順序為:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性強
C. 元素B的氫化物可能具有正四面體結構
D. 化合物A4BC2D既可能是共價化合物,也可是離子化合物
【答案】B
【解析】A、B、C、D、E、F是原子序數依次增大的短周期主族元素。E是同周期元素金屬性最強的元素,則E為鈉元素;根據流程圖推導,且甲是生活中的調味品,丁是淡黃色固體,可知甲為氯化鈉,丁為過氧化鈉,則丙為碳酸鈉,乙為氫氧化鈉,戊是二氧化碳,則A、B、C、D、E、F分別為H、C、N、O、Na、Cl。A. 同周期性元素從左到右原子半徑逐漸減小,同主族元素從上而下原子半徑逐漸增大,故原子半徑由大到小的順序為:r(Na)>r(Cl)>r(N)>r(O),選項A正確;B. 元素Cl的最高價氧化物的水物化的酸性一定比硫酸酸性強,若不是最高價氧化物的水化物,則可能比較弱,如HClO是弱酸,選項B不正確;C. 元素B的氫化物CH4具有正四面體結構,選項C正確;D. 化合物A4BC2D既可能是共價化合物CO(NH2)2,也可是離子化合物NH4CNO,選項D正確。答案選B。
【題型】單選題
【結束】
6
【題目】下圖所示裝置可間接氧化工業廢水中含氮離子(NH4+)。下列說法不正確的是

A. 乙是電能轉變為化學能的裝置
B. 含氮離子氧化時的離子方程式為:3Cl2 + 2NH4+=N2 + 6Cl-+8H+
C. 若生成H2和N2的物質的量之比為3:1,則處理后廢水的pH減小
D. 電池工作時,甲池中的Na+移向Mg電極
科目:高中化學 來源: 題型:
【題目】已知Na2SO3固體與硫酸可發生反應:Na2SO3+ H2SO4=Na2SO4+H2O+SO2↑,下圖是實驗室制取SO2并驗證SO2的某些性質的裝置圖。回答正確的是( )

A. ①中的實驗現象為紫色石蕊試液褪色此實驗證明SO2具有漂白性
B. ③中溶液變渾濁是因為SO2和H2S發生了氧化還原反應,氧化產物和還原產物質量比為1∶1
C. ④和②中溶液均褪色,但褪色的原理不同
D. 實驗室中可以用澄清石灰水代替氫氧化鈉溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】醋酸亞鉻水合物[Cr(CH3COO)2]2·2H2O是一種氧氣吸收劑,為紅棕色晶體,易被氧化,微溶于乙醇,不溶于水和乙醚(易揮發的有機溶劑)。其制備裝置及步驟如下:
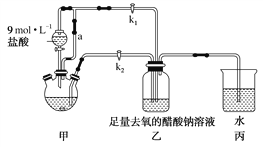
①檢查裝置氣密性,往三頸燒瓶中依次加入過量鋅粉、適量CrCl3溶液。
②關閉k2打開k1,旋開分液漏斗的旋塞并控制好滴速。
③待三頸燒瓶內的溶液由深綠色(Cr3+)變為亮藍色(Cr2+)時,把溶液轉移到裝置乙中,當出現大量紅棕色晶體時,關閉分液漏斗的旋塞。
④將裝置乙中混合物快速過濾、洗滌和干燥,稱量得到2.76 g[Cr(CH3COO)2]2·2H2O。
(1)裝置甲中連通管a的作用是______________________。
(2)三頸燒瓶中的Zn除了與鹽酸生成H2外,發生的另一個反應的離子方程式為______________________。
(3)實驗步驟③中溶液自動轉移至裝置乙中的實驗操作為______________________。
(4)裝置丙中導管口水封的目的是______________________。
(5)洗滌產品時,為了去除可溶性雜質和水分,下列試劑的正確使用順序是________(填字母)。
a.乙醚 b.去氧冷的蒸餾水 c.無水乙醇
(6)若實驗所取用的CrCl3溶液中含溶質3.17 g,則[Cr(CH3COO)2]2·2H2O(相對分子質量為376)的產率是______________________。
(7)一定條件下,[Cr(CH3COO)2]2·2H2O受熱得到CO和CO2的混合氣體,請設計實驗檢驗這兩種氣體的存在________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】按如圖各裝置進行實驗能成功完成相應實驗的是
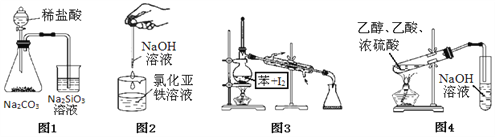
A. 圖1:證明非金屬性強弱:C>Si B. 圖2:制備氫氧化亞鐵
C. 圖3:分離碘并回收苯 D. 圖4:制取和收集乙酸乙酯
【答案】C
【解析】A、稀鹽酸易有揮發性,反應產生的二氧化碳中含有氯化氫,能使硅酸鈉反應生成硅酸沉淀的不一定是碳酸,故無法證明非金屬性C>Si,選項A錯誤;B、為防止制得的的氫氧化亞鐵被氧化,必須將滴管插到液面以下或在液面上加苯覆蓋以防止空氣中氧氣進入溶液氧化產生的氧化亞鐵,選項B錯誤;C、碘溶于苯中,利用沸點的不同蒸餾使苯分離出來并回收苯,實驗裝置及操作正確,選項C正確;D、制取和收集乙酸乙酯時必須用飽和碳酸鈉溶液吸收乙酸乙酯而不能用氫氧化鈉溶液,選項D錯誤。答案選C。
【題型】單選題
【結束】
5
【題目】A、B、C、D、E、F是原子序數依次增大的短周期主族元素。E是同周期元素金屬性最強的元素。甲、乙、丙、丁、戊是由上述部分元素中的兩種或幾種組成的化合物,它們的轉化關系如圖所示。其中甲是生活中的調味品,丁是淡黃色固體。下列說法不正確的是
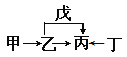
A. 原子半徑由大到小的順序為:r(E)>r(F)>r(C)>r(D)
B. 元素F的氧化物的水物化的酸性一定比硫酸酸性強
C. 元素B的氫化物可能具有正四面體結構
D. 化合物A4BC2D既可能是共價化合物,也可是離子化合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】李時珍在《本草綱目》中寫到“燒酒非古法也,自元時始創其法。用濃酒精和糟入甑,蒸令氣上,用器承取滴露。”文中涉及的操作方法是
A.分液B.萃取C.過濾D.蒸餾
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列反應中一定屬于吸熱反應的是( )
A.需加熱或點燃才能引發的反應
B.氧化還原反應
C.氫氧化鋇晶體和氯化銨晶體混合攪拌
D.一氧化碳和氧氣反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列儀器在使用之前需要檢查是否漏液的是( )
①分液漏斗 ②長頸漏斗 ③容量瓶 ④蒸餾燒瓶 ⑤洗氣瓶.
A. ①②③ B. ①③ C. ①③⑤ D. ①②③④
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下圖表示某固態單質A及其化合物之間的轉化關系(某些產物和反應條件已略去).化合物B在常溫常壓下為氣體,B和C的相對分子質量之比為4:5,化合物D是重要的工業原料. 
(1)寫出A在加熱條件下與H2反應的化學方程式
(2)寫出E與A的氫化物反應生成A的化學方程式
(3)寫出一個由D生成B的化學方程式;
(4)將5mL0.10molL﹣1的E溶液與10mL0.10molL﹣1的NaOH溶液混合. ①寫出反應的離子方程式;
②反應后溶液的pH7(填“大于”、“小于”或“等于”),理由是;
③加熱反應后的溶液,其pH(填“增大”、“不變”或“減小”),理由是 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com