
(Ⅰ)(4分)自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO。
(1)反應需要在閃電或極高溫條件下發生,說明該反應_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同溫度下,反應N2(g)+O2(g)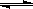 2NO(g)的平衡常數K如下表:
2NO(g)的平衡常數K如下表:
|
溫度/℃ |
1538 |
1760 |
2404 |
|
平衡常數K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
該反應的△H 0。(填“>”、“=”或“<”)
(3)2404℃時,在容積為1.0L的密閉容器中通入2.6mol N2和2.6mol O2,計算反應N2(g)+O2(g) 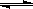 2NO(g)達到平衡時NO的濃度為
。(此溫度下不考慮O2與NO的反應。計算結果保留兩位有效數字)
2NO(g)達到平衡時NO的濃度為
。(此溫度下不考慮O2與NO的反應。計算結果保留兩位有效數字)
(Ⅱ)(5分)在容積為1L的密閉容器中,進行如下反應:A(g)+2B(g)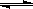 C(g)+D(g),不同溫度下,D的物質的量n(D)和時間t的關系如圖。試回答下列問題:
C(g)+D(g),不同溫度下,D的物質的量n(D)和時間t的關系如圖。試回答下列問題:
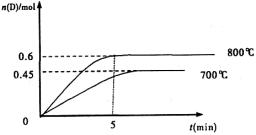
(1)能判斷該反應達到化學平衡狀態的依據是 。
A.容器中壓強不變 B.混合氣體中c(A)不變
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用圖中數據計算800℃時的平衡常數
K= ,該反應為 反應(填吸熱或放熱)
(3)700℃時,某時刻測得體系中各物質的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,則此時該反應 進行(填“向正反應方向”“向逆反應方向”或“處于平衡狀態”)。
科目:高中化學 來源: 題型:
 自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO.
自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO.| 溫度/℃ | 1538 | 1760 | 2404 |
| 平衡常數K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
 自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO.
自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO.| 溫度/℃ | 1538 | 1760 | 2404 |
| 平衡常數K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
查看答案和解析>>
科目:高中化學 來源: 題型:
自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO。
(1)反應需要在閃電或極高溫條件下發生,說明該反應_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同溫度下,反應N2(g)+O2(g)![]() 2NO(g)的平衡常數K如下表:
2NO(g)的平衡常數K如下表:
| 溫度/℃ | 1538 | 1760 | 2404 |
| 平衡常數K | 0.86×10-4 | 2.6×10-4 | 64×10-4 |
①該反應的△H 0。
(填“>”、“=”或“<”)
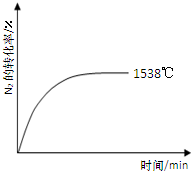
②其他條件相同時,在上述三個溫度下分別發生該反應。1538℃時,N2的轉化率隨時間變化如右圖所示,請補充完成1760℃、2404℃時N2的轉化率隨時間變化的示意圖。
(3)2404℃時,在容積為1.0L的密閉容器中通入2.6mol N2和2.6mol O2,計算反應
N2(g)+O2(g) 2NO(g)達到平衡時NO的濃度。(此溫度下不考慮O2與NO的反應。計算結果保留兩位有效數字)
2NO(g)達到平衡時NO的濃度。(此溫度下不考慮O2與NO的反應。計算結果保留兩位有效數字)
查看答案和解析>>
科目:高中化學 來源:2012-2013學年河北省高三第二次模擬考試化學試卷(解析版) 題型:填空題
(8分)自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO。
(1)反應需要在閃電或極高溫條件下發生,說明該反應_________。(填字母)
A.所需的活化能很高 B.吸收的能量很多
(2)在不同溫度下,反應N2(g)+O2(g)
 2NO(g)的平衡常數K如下表:
2NO(g)的平衡常數K如下表:
|
溫度/℃ |
1538 |
1760 |
2404 |
|
平衡常數K |
0.86×10-4 |
2.6×10-4 |
64×10-4 |
該反應的△H 0。(填“>”、“=”或“<”)
(3)一定條件下該反應在密閉容器中達到平衡后,要提高N2的轉化率, 可以采取的措施是 。
A.降低溫度 B.加催化劑
C.增加壓強 D.增加O2濃度
E.分離出一氧化氮
(4)2404℃時,在容積為1.0L的密閉容器中通入2.6mol N2和2.6mol O2,計算反應:
N2(g)+O2(g)
 2NO(g)達到平衡時NO的濃度 。(此溫度下不考慮O2與NO的反應,計算結果保留兩位有效數字)
2NO(g)達到平衡時NO的濃度 。(此溫度下不考慮O2與NO的反應,計算結果保留兩位有效數字)
(5) NO在科學界被譽為“明星分子”, 用NO與O2反應可以制備NO2,NO2是一種優良的氧化劑。已知 火箭發射時可用肼(N2H4)作燃料,NO2作氧化劑,這兩者反應生成N2和H2O(氣)。
且:N2(g)+2O2(g)=2NO2(g) △H=+67.7kJ/mol
N2H4(g)+O2(g)=N2(g)+2H2O(g) △H=-534kJ/mol
請寫出肼與NO2反應的熱化學方程式_______________________________________________
查看答案和解析>>
科目:高中化學 來源:2011-2012學年安徽省高三第四次月考化學試卷 題型:填空題
(12分)自然界里氮的固定途徑之一是在閃電的作用下,N2與O2反應生成NO。
(1)在不同溫度下,反應N2(g)+O2(g) 2NO(g) △H=a kJ·mol-1的平衡常數K如下表:
2NO(g) △H=a kJ·mol-1的平衡常數K如下表:
|
溫度/℃ |
1538 |
1760 |
2404 |
|
平衡常數K |
0、86×10-4 |
2、6×10-4 |
64×10-4 |
①該反應的△H 0(填“>”、“=”或“<”)。
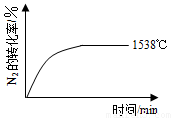
②其他條件相同時,在上述三個溫度下分別發生該反應。1538℃時,N2的轉化率隨時間變化如圖所示,
請補充完成1760℃時N2的轉化率隨時間變化的示意圖。
(2)科學家一直致力于研究常溫、常壓下“人工固氮”的新方法。曾有實驗報道:在常溫、常壓、光照條件下,N2在催化劑(摻有少量Fe2O3的TiO2)表面與水發生反應,生成的主要產物為NH3。相應的熱化學方程式如下:
2N2(g)+6H2O(1) =4NH3(g)+3O2(g) △H=+1530kJ·mol-1
則氨催化氧化反應4NH3(g)+5O2(g) =4NO(g)+6H2O(1) 的反應熱△H= 。
(用含a的代數式表示)
(3)最近一些科學家研究采用高質子導電性的SCY陶瓷(能傳遞H+)實現氮的固定——氨的電解法合成,大大提高了氮氣和氫氣的轉化率。總反應式為:N2+3H2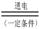 2NH3。則在電解法合成氨的過程中,應將H2不斷地通入
極(填“正”、“負”、 “陰” 或“陽”);在另一電極通入N2,該電極反應式為 。
2NH3。則在電解法合成氨的過程中,應將H2不斷地通入
極(填“正”、“負”、 “陰” 或“陽”);在另一電極通入N2,該電極反應式為 。
 (4)合成氨的反應N2(g)+3H2(g)
(4)合成氨的反應N2(g)+3H2(g)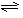 2NH3(g) △H =
-92、4 kJ·mol-1,一定條件下的密閉容器中,該反應達到平衡,要提高N2的轉化率,可以采取的措施是__________(填字母代號)。
2NH3(g) △H =
-92、4 kJ·mol-1,一定條件下的密閉容器中,該反應達到平衡,要提高N2的轉化率,可以采取的措施是__________(填字母代號)。
a、升高溫度 b、加入催化劑 c、增加H2的濃度
d、增加N2的濃度 e、分離出NH3
(5)在25℃下,將a mol·L-1的氨水與0、01 mol·L-1的鹽酸等體積混合,反應后溶液中c(NH4+)=c(Cl-),則溶液顯_____________性(填“酸”“堿”或“中”), 可推斷a 0、01(填大于、等于或小于)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com