
【題目】下列反應符合圖示的是( ) 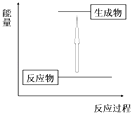
A.紅熱的炭與水蒸氣反應制取水煤氣
B.鋅與稀硫酸的反應
C.酸堿中和反應
D.二氧化硫的催化氧化反應
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】甲醇是重要的化工原料,又是一種可再生能源,具有廣泛的開發(fā)和應用前景。
(1)已知反應CO(g)+2H2(g) ![]() CH3OH(g)H=-99kJ.mol-1中的相關(guān)化學鍵鍵能如下:
CH3OH(g)H=-99kJ.mol-1中的相關(guān)化學鍵鍵能如下: 
則x=。
(2)在一容積可變的密閉容器中,1molCO與2molH2發(fā)生反應:CO(g)+2H2(g) ![]() CH3OH(g) H1<0,CO在不同溫度下的平衡轉(zhuǎn)化率(α)與壓
CH3OH(g) H1<0,CO在不同溫度下的平衡轉(zhuǎn)化率(α)與壓
強的關(guān)系如下圖所示。
①a、b兩點的反應速率:v(a)v(b)(填“>”“<”或“=”)。
②T1T2(填“>”“<”或“=”),原因是。
③在c點條件下,下列敘述能說明上述反應能達到化學平衡狀態(tài)的是(填代號)
a.H2的消耗速率是CH3OH生成速率的2倍 b.CH3OH的體積分數(shù)不再改變
c.混合氣體的密度不再改變 d.CO和CH3OH的物質(zhì)的量之和保持不變
④圖中a點的平衡常數(shù)KP=(用平衡分壓代替平衡濃度計算,分壓=總壓×物質(zhì)的量分數(shù))。
(3)利用合成氣(主要成分為CO和H2)合成甲醇,發(fā)生主要反應如下:I:CO(g)+2H2(g) ![]() CH3OH(g) H1II:CO2(g)+H2(g)
CH3OH(g) H1II:CO2(g)+H2(g) ![]() CO(g) + H2O(g) H2III:CO2(g)+3H2(g)
CO(g) + H2O(g) H2III:CO2(g)+3H2(g) ![]() CH3OH(g) + H2O(g) H3
CH3OH(g) + H2O(g) H3
上述反應對應的平衡常數(shù)分別為K1、K2、K3 , 它們隨溫度變化曲線如下圖所示。
則H1H3(填“>”、“<”、“=”), 理由是。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】A元素原子的L電子層比B元素原子的L電子層少3個電子,B元素原子核外總電子數(shù)比A 元素原子電子總數(shù)多5個,則A、B形成化合物可能是
A. 離子化合物ABB. 離子化合物B3A2
C. 離子化合物B2(AO3)3D. 離子化合物A2BO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】膠體區(qū)別于其它分散系的本質(zhì)特征是
A. 膠體粒子直徑在1-100nm之間 B. 膠體粒子帶電荷
C. 膠體粒子不能穿過半透膜 D. 膠體粒子能夠發(fā)生布朗運動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一位同學為探究元素周期表中元素性質(zhì)的遞變規(guī)律,設計了如下列實驗.
(1)根據(jù)題意解答 (i)將鈉、鉀、鎂、鋁各1mol分別投入到足量的同濃度的鹽酸中,試預測實驗結(jié)果:與鹽酸反應最劇烈,與鹽酸反應的速度最慢;與鹽酸反應產(chǎn)生的氣體最多.
(ii)向Na2S溶液中通入氯氣出現(xiàn)黃色渾濁,可證明Cl的非金屬性比S強,反應的離子方程式為 .
(2)利用如圖裝置可驗證同主族元素非金屬性的變化規(guī)律: 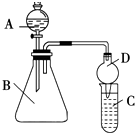
(i)儀器B的名稱為 , 干燥管D的作用為 .
(ii)若要證明非金屬性:Cl>I,則A中加濃鹽酸,B中加KMnO4(KMnO4與濃鹽酸常溫下反應生成氯氣),C中加淀粉碘化鉀混合溶液,觀察到C中溶液的現(xiàn)象,即可證明.從環(huán)境保護的觀點考慮,此裝置缺少尾氣處理裝置,可用溶液吸收尾氣.
(iii)若要證明非金屬性:C>Si,則在A中加鹽酸、B中加CaCO3、C中加Na2SiO3溶液,觀察到C中溶液的現(xiàn)象,即可證明.但有的同學認為鹽酸具有揮發(fā)性,可進入C中干擾實驗,應在兩裝置間添加裝有溶液的洗氣瓶除去.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列屬于氧化還原反應的是( )
A.2KI+Br2═2KBr+I2
B.CaCO3 ![]() CaO+CO2↑
CaO+CO2↑
C.SO3+H2O ![]() H2SO4
H2SO4
D.MgCl2+2NaOH ![]() Mg(OH)2↓+NaCl
Mg(OH)2↓+NaCl
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】如圖所示是部分短周期元素主要化合價與原子序數(shù)的關(guān)系圖,下列說法不正確的是( ) 
A.X和W位于同一主族
B.原子半徑:Y>Z>X
C.鹽YRX與化合物WX2的漂白原理相同
D.Y和R兩者的最高價氧化物對應的水化物能相互反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某元素原子的最外層電子數(shù)是次外層電子數(shù)的3倍,且最外層電子數(shù)與次外層電子數(shù)之和小于10。該元素為
A. 鋰B. 鈹C. 氧D. 鈣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20.0mL 0.10molL﹣1的NaOH溶液中逐滴加入0.10molL﹣1的醋酸溶液,溶液pH隨醋酸溶液體積的變化如圖所示.下列說法正確的是( ) 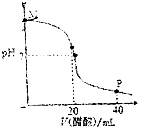
A.N點處恰好完全反應,c(CH3COO﹣)=c(CH3COOH)
B.O點處顯中性,c(CH3COO﹣)=c(Na+)=c(H+)=c(OH﹣)
C.M點到O點過程中,可能出現(xiàn)c(CH3COO﹣)>c(Na+)
D.P點處顯酸性,c(CH3COO﹣)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com