
【題目】2005年10月12日北京時間上午9時,中國酒泉衛星發射中心成功將“神舟6號”飛船送入太空,這一壯舉又一次受到世界關注.火箭推進器中有強還原劑液體肼(N2H4)和強氧化劑液態雙氧水.當它們混合時,即產生大量氮氣和水蒸氣并放出大量熱.已知:0.4mol液態肼與足量的液態雙氧水反應生成氮氣和水蒸氣,放出256.652kJ的熱量.
(1)反應的熱化學方程
(2)又已知H2O(l)=H2O(g)△H=44kJ.mol﹣1 . 則16g液態肼與足量的液態雙氧水反應生成氮氣和液態水時放出的熱量是kJ.
(3)此反應用于火箭推進,除釋放大量熱和快速產生大量氣體外還有一個很大優點是 .
(4)燃料電池在航天器得到大量應用;科研人員新近開發出一種由甲醇、氧氣以及強堿作電解質溶液的新型手機電池,充電一次可供手機連續使用一個月,據此請回答以下問題:
①甲醇是極,電極反應
②電池反應的離子方程式為 .
【答案】
(1)N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.63kJ/mol
(2)408.815
(3)產物無污染
(4)負,CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O,2CH3OH+3O2+4OH﹣═2CO32﹣+6H2O
【解析】解:(1)反應方程式為:N2H4+2H2O2═N2+4H2O,0.4mol液態肼放出256.652KJ的熱量,則1mol液態肼放出的熱量為 ![]() =641.63kJ,
=641.63kJ,
所以反應的熱化學方程式為:N2H4(g)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.63kJ/mol;
(2)①N2H4(l)+2H2O2(l)═N2(g)+4H2O(g)△H=﹣641.63kJ/mol;
②H2O(g)=H2O(l)△H=﹣44kJ/mol;
依據蓋斯定律①+②×4得到:N2H4(l)+2H2O2(l)═N2(g)+4H2O(l);△H=﹣817.63kJ/mol;
熱化學方程式中32g全部反應放熱817.63kJ,16g液態肼與足量雙氧水反應生成氮氣和液態水時,放出的熱量為:817.63kJ× ![]() =408.815kJ;
=408.815kJ;
(3)還原劑肼(N2H4)和強氧化劑H2O2,當它們混合時,即產生大量的氮氣和水蒸氣,除釋放大量熱量和快速產生大量氣體外,還有很突出的優點是,產物為氮氣和水,清潔無污染;
(4)CH3OH和O2在電池中,肯定是O2氧化CH3OH,CH3OH是負極反應物,O2是正極反應物.CH3OH被氧化生成CO2和H2O,電解質溶液中有強堿(OH﹣),CO2要轉化CO32﹣.
①甲醇是負極,電極反應式為:CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O;
②CH3OH被氧化生成CO2和H2O,電解質溶液中有強堿(OH﹣),則CO2要轉化CO32﹣,電池反應為:2CH3OH+3O2+4OH﹣═2CO32﹣+6H2O;
故答案為:(1)N2H4(g)+2H2O2(l)=N2(g)+4H2O(g)△H=﹣641.63kJ/mol;(2)408.815;(3)產物無污染;(4)①負;CH3OH+8OH﹣﹣6e﹣═CO32﹣+6H2O;②2CH3OH+3O2+4OH﹣═2CO32﹣+6H2O.
(1)根據題干信息確定1mol物質燃燒放出的熱量,再得出反應的熱化學方程式;
(2)根據蓋斯定律確定反應放出的熱量;
(3)燃燒產物是水和氮氣,對大氣無污染;
(4)在燃料電池中,燃料作為負極反應物,發生氧化反應;根據化合價變化確定得失電子數,再根據電荷守恒、原子守恒進行配平。


科目:高中化學 來源: 題型:
【題目】已知短周期主族元素Q、T、U、V、W、X、Y、Z原子序數依次增大。已知:T與U、V同周期,W與X、Y、Z同周期,U和Y同族;元素Q的某種核素沒有中子;元素T的最高正價與最低負價的代數和為0;Q與U形成的氣態化合物在標準狀況下的密度為0.76g/L;工業上通過分離液態空氣獲得V的單質,且該單質的某種同素異形體是保護地球地表環境的重要屏障;W、X、Z的最高價氧化物對應的水化物兩兩之間都能反應,且W、X、Z原子最外層電子數之和等于W的原子序數。
(1)V元素原子的 L層電子數為______。元素 W 在周期表中的位置為______。
(2)用電子式表示化合物 QZ的形成過程______。
(3)U的氫化物比同主族其他元素的氫化物的熔沸點明顯偏高,原因是______。
(4)寫出X、Z 兩種元素最高價氧化物對應的水化物相互反應的離子方程式:______。
(5)T、U、V形成的氫化物分子中共價鍵的極性由強到弱的順序為______。(填化學式)
(6)Q與T可形成一種化合物T2Q4,請寫出該分子的結構式________。
(7)元素Y的一種含氧酸化學式為 H3YO3,其結構式可表示為: 。該酸為______元酸,請寫出該酸與過量氫氧化鈉溶液反應的化學方程式______。(已知信息:氫氧原子結合成的一種原子團“—OH”叫羥基,含氧酸中只有羥基氫才可電離出 H+。)
。該酸為______元酸,請寫出該酸與過量氫氧化鈉溶液反應的化學方程式______。(已知信息:氫氧原子結合成的一種原子團“—OH”叫羥基,含氧酸中只有羥基氫才可電離出 H+。)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,對于密閉容器中進行的可逆反應:2HI(g) ![]() H2(g)+I2(g),下列說法中可以充分說明這一反應已經達到化學平衡狀態的是( )
H2(g)+I2(g),下列說法中可以充分說明這一反應已經達到化學平衡狀態的是( )
A.HI、H2、I2的濃度相等
B.HI、H2、I2的濃度不再發生變化
C.HI、H2、I2在密閉容器中共存
D.容器內氣體的顏色不再發生變化
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在“觀察DNA和RNA在細胞中的分布”實驗中,使用鹽酸的目的是 ( )
①改變細胞膜的流動性
②改變細胞膜的通透性
③改變細胞膜的化學組成
④將DNA與蛋白質分離
⑤將RNA與蛋白質分離
⑥利于RNA與染色劑結合
⑦利于蛋白質與染色劑結合
⑧利于DNA與染色劑結合
A.①④⑥ B.②④⑧ C.③⑤⑦ D.②⑤⑥
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】1828年,德國化學家弗里德里希·維勒首次使用(NH4)2SO4與氰酸鉀KCNO人工合成了尿素CO(NH2)2,打破了有機化合物的"生命力"學說。
(1) (NH4)2SO4與KCNO合成尿素反應的化學方程式為____________。
(2)某小組同學在實驗室條件下,擬用CO2和NH3,在催化劑的作用下合成尿素。
①用CO2和NH3合成尿素 CO(NH2)2反應的化學方程式為____________。
②實驗所需的CO2可用多種裝置來制備,要想達到“隨開隨用、隨關隨停”的目的,下列裝置A、B、C、D、E中符和要求的有____________(填字母)。
③若用F裝置收集氨氣,則氣體應由導管口____________(填“a”或“b”)進入。




(3)尿素樣品中氮含量可以用甲醛法標定,其原理如下:首先用濃硫酸分解試樣,使試液中的胺生成硫酸銨并放出二氧化碳;將過量的硫酸中和后得到中性銨鹽,再用甲醛(HCHO)與硫酸銨作用生成六次甲基四銨鹽離子(CH2)6N4H+和硫酸;最后用標準氫氧化鈉溶液滴定。
①甲醛與硫酸銨反應的離子方程式為____________;
②滴定選用的指示劑為____________。滴定終點的現象為____________。
③若稱取樣品m g,溶解后配成250mL溶液。取25.00mL樣品溶液于250 mL錐形瓶中,加入10mL w%的甲醛溶液,充分反應后,加入1~2滴指示劑,用濃度為a mol/L的NaOH標準溶液滴定至終點(已知滴定時,1 mol六次甲基四銨鹽離子(CH2)6N4H+消耗OH﹣的能力與1mol H+相當)。重復2次,消耗NaOH標準溶液的體積平均值為b mL。則該樣品中氮的質量分數為____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列裝置由甲、乙部分組成(如圖所示),甲是將廢水中乙二胺[H2N(CH2)2NH2]氧化為環境友好物質形成的化學電源。當電池工作時,下列說法正確的是

A. 電子的流動方向M→Fe→CuSO4溶液→Cu-N
B. M極電極反應式: H2N(CH2)2NH2+16OH--16e-==2CO2↑+N2↑+12H2O
C. 當N極消耗5.6LO2時,則鐵極增重32g
D. 一段時間后,乙中CuSO4溶液濃度基本保持不變
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列敘述正確的是( )
A.非金屬元素之間構成的化合物都不是離子化合物
B.陰、陽離子通過靜電引力所形成的化學鍵叫離子鍵
C.離子化合物中一定沒有共價鍵
D.含有陽離子的化合物一定含有陰離子
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向一體積不變的密閉容器中充入2mol A、0.6mol C和一定量的B三種氣體,一定條件下發生反應2A(g)+B(g)3c(g),各物質的濃度隨時間變化的關系如圖1所示,其中如t0~t1階段c(B)未畫出.圖2為反應體系中反應速率隨時間變化的情況,且t2、t3、t4各改變一種不同的條件.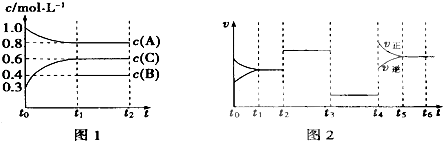
(1)若t1=15min,則t0~t1階段以c的濃度變化表示的反應速率V(C)= .
(2)t3時改變的條件為 , B的起始物質的量為 .
(3)t4~t5階段,若A的物質的量減少了0.01mol,而此階段中反應體系吸收能量為a kJ,寫出此條件下該反應的熱化學方程式: .
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】乙二醇(沸點:197.3℃)是一種重要的基礎化工原料。由煤基合成氣(主要成分CO、H2)與氧氣先制備得到草酸二甲酯(沸點:164.5℃),再加氫間接合成乙二醇,具有反應條件溫和、環境污染小等優點。反應過程如下:
反應I:4NO(g)+4CH3OH(g)+O2(g)![]() 4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
4CH3ONO(g)+2H2O(g) △H1 =a kJ·mol-1
反應II:2CO(g)+2CH3ONO(g)![]() CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
CH3OOCCOOCH3(l)+2NO(g) △H2=b kJ·mol-1
反應III:CH3OOCCOOCH3(1)+4H2(g)![]() HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
HOCH2CH2OH(1)+2CH3OH(g)△H3 =c kJ·mol-1
請回答下列問題:
(1)煤基合成氣間接合成乙二醇的總熱化學方程式是_____________________________,已知該反應在較低溫條件下能自發進行。說明該反應的△H ______0(填“>”“<”或“=”)。
(2)CO、CH3ONO各0.4mol在恒溫、容積恒定為2L的密閉容器中發生反應II,達到平衡時CO的體積分數與NO的體積分數相等,計算該反應的化學平衡常數K=_____________。若此時向容器中再通入0.4molNO,一段時間后,達到新平衡時NO的體積分數與原平衡時相比______(填“增大”“相等”“減小”或“不能確定”)。
(3)溫度改變對反應II的催化劑活性有影響,評價催化劑的活性參數——空時收率和CO的選擇性可表示如下:
空時收率=CH3OOCCOOCH3質量/反應時間×催化劑的體積
CO的選擇性=合成[CH3OOCCOOCH3所消耗的CO的物質的量/反應掉的CO的物質的量]×100%
在不同溫度下,某學習小組對四組其他條件都相同的反應物進行研究,經過相同時間th,測得空時收率、CO的選擇性數據如下表所示。
反應溫度(℃) | 空時收率(g·mL-1·h-1) | CO的選擇性(%) |
130 | 0.70 | ①72.5 |
140 | 0.75 | ②71.0 |
150 | 0.71 | ③55.6 |
160 | 0.66 | ④63.3 |
下列說法正確的是________(填字母代號)。
A.溫度升高,空時收率先增大后減小,說明△H2>0
B.溫度升高,催化劑活性逐漸減弱,對CO的選擇性逐漸降低
C.綜合考慮空時收率和CO的選擇性,工業生成CH3OOCCOOCH3時,選擇140℃效果最好
D.130℃時,CO的選擇性最高,說明CO生成CH3OOCCOOCH3的轉化率最高
(4)120℃、常壓時,CH3OOCCOOCH3+4H2![]() HOCH2CH2OH+2CH3OH反應過程中的能量變化如圖所示。畫出180℃、常壓時,加入催化劑,該反應過程中的能量變化圖。________
HOCH2CH2OH+2CH3OH反應過程中的能量變化如圖所示。畫出180℃、常壓時,加入催化劑,該反應過程中的能量變化圖。________
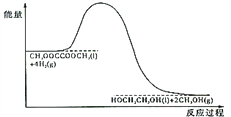
(5)研究證實,乙二醇、氧氣可以在堿性溶液中形成燃料電池,負極的電極反應式是________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com