
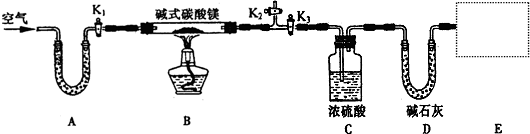
某研究性學習小組為測定NH3分子中氮、氫原子個數比,設計如下實驗流程:

實驗時,先用制得的氨氣排盡洗氣瓶前所有裝置中的空氣,再連接洗氣瓶和氣體收集裝置,立即加熱氧化銅。
下圖A、B、C為該小組制取氨氣時可能用到的裝置,D為盛有濃硫酸的洗氣瓶。

請回答下列問題:
(1)寫出儀器的名稱:a ,b 。
(2)硬質玻璃管中發生的反應方程式是 ,反應過程中硬質玻璃管的現象是 。
(3)請判斷制取氨氣可能用到的裝置,在下表中你認為可行的裝置中填寫對應的實驗藥品(寫出化學式)。
|
裝置 |
實驗藥品 |
|
A |
|
|
B |
b: a: |
|
C |
c: 隔板: |
(4)實驗時洗氣瓶D中的濃硫酸表現 性;該小組實驗測得:洗氣前裝置D的質量為m1g、洗氣后裝置D的質量為m2g、生成的氮氣在標準狀況下的體積為V L。根據該小組計算NH3分子中氮、氫的原子個數比的表達式,請預計該結果與理論值相比, 。
A.在實驗誤差范圍內數值接近理論值 B.數值偏高 C.數值偏低
(1)圓底燒瓶(2分),分液漏斗(2分)
(2)2NH3+3CuO 3Cu+N2+3H2O(2分),黑色固體變成紅色(2分)
3Cu+N2+3H2O(2分),黑色固體變成紅色(2分)
(3)(每種可行裝置各2分,共4分)
|
裝置 |
實驗藥品 |
|
A |
NH4Cl、Ca(OH)2 |
|
B |
b:NH3·H2O(aq) a:CaO或 NaOH或CaO、NaOH |
(4)吸水和酸(2分), C (2分)
【解析】
試題分析:(1)從圖中可知儀器a的名稱為:圓底燒瓶,b為分液漏斗;
(2)根據試驗流程制取得到的氨氣干燥后通入了硬質玻璃管中,并在加熱下與CuO發生了反應,由于CuO有氧化性,氨氣有還原性,所以二者發生氧化還原反應,方程式為2NH3+3CuO 3Cu+N2+3H2O,由此可知有銅單質生成,所以可觀察到現象是黑色固體變成了紅色物質。
3Cu+N2+3H2O,由此可知有銅單質生成,所以可觀察到現象是黑色固體變成了紅色物質。
(3)圖中A、B、C為該小組制取氨氣時可能用到的裝置,所以根據氨氣制備的原理,可以是固-固加熱型,也可以是固-液不加熱型,所以根據裝置類型可以選用相應實驗藥品為:
|
裝置 |
實驗藥品 |
|
A |
NH4Cl、Ca(OH)2 |
|
B |
b:NH3·H2O(aq) a:CaO或 NaOH或CaO、NaOH |
(4)由于洗氣瓶D中的濃硫酸不但吸收了反應生成的水,還吸收了過量的氨氣,所以表現的是濃硫酸的吸水性和酸性;正因為濃硫酸吸收了水和氨氣,所以根據該計算公式,會使計算的H的量偏高,則N:H反而變小,小于理論值。
考點:本題考查的是利用氨氣的還原性進行的探究實驗,還考查了氨氣的實驗室制備和濃硫酸性質。


 海淀黃岡名師導航系列答案
海淀黃岡名師導航系列答案 普通高中同步練習冊系列答案
普通高中同步練習冊系列答案科目:高中化學 來源: 題型:閱讀理解
| ||
| ||
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解

查看答案和解析>>
科目:高中化學 來源: 題型:
 實驗室用H2O2分解反應制取氧氣時,常加入催化劑以加快反應速率,某研究性學習小組為研究催化劑FeCl3的量對O2生成速率的影響,設計了如下三組實驗方案(見下表),將表中所給的試劑按一定體積混合后進行反應.
實驗室用H2O2分解反應制取氧氣時,常加入催化劑以加快反應速率,某研究性學習小組為研究催化劑FeCl3的量對O2生成速率的影響,設計了如下三組實驗方案(見下表),將表中所給的試劑按一定體積混合后進行反應.| 實驗編號 試劑 |
A | B | C |
| 10% H2O2/mL | 20.0 | V1 | V2 |
| 2mol/L FeCl3/mL | 0 | 5.0 | 10.0 |
| H2O/mL | V3 | V4 | 0 |
查看答案和解析>>
科目:高中化學 來源: 題型:

查看答案和解析>>
科目:高中化學 來源:2012-2013學年福建省5月高考三輪模擬化學試卷(解析版) 題型:填空題
(1)M由兩種短周期元素組成,每個M分子含有18個電子,其分子球棍模型如圖所示。測得M的摩爾質量為32g/mol。畫出編號為2的原子結構示意圖: 。

(2)已知1.0mol·L—1NaHSO3溶液的pH為3.5,加入氯水,振蕩后溶液pH迅速降低。溶液pH降低的原因是 (用離子方程式表示)。
(3)在常溫常壓和光照條件下,N2在催化劑(TiO2)表面與H2O反應,生成1molNH3和O2時的能量變化值為382.5kJ,達到平衡后此反應NH3生成量與溫度的實驗數據如下表。則該反應的熱化學方程式為 。
|
T/K |
303 |
313 |
323 |
|
NH3生成量/(10—1mol) |
4.3 |
5.9 |
6.0 |
(4)在溶液中,一定濃度的NH4+能溶解部分Mg(OH)2固體,反應如下:
2NH4+(aq) + Mg(OH)2(s)
 Mg2+(aq)
+2NH3·H2O(aq)
Mg2+(aq)
+2NH3·H2O(aq)
寫出上述反應的平衡常數表達式
某研究性學習小組為探究Mg2+與NH3·H2O反應形成沉淀的情況,設計如下兩組實驗
|
實驗① |
等體積1 mol/L氨水和0.1 mol/L MgCl2溶液混合 |
生成白色沉淀 |
|
實驗② |
等體積0.1 mol/L氨水和1 mol/L MgCl2溶液混合 |
無現象 |
請分析實驗①、②產生不同現象的原因: 。
(5)在室溫下,化學反應I—(aq)+ ClO—(aq) = IO—(aq) + Cl—(aq)的反應物初始濃度、溶液中的氫氧根離子初始濃度及初始速率間的關系如下表所示:
|
實驗編號 |
I—的初始濃度 (mol·L—1) |
ClO—的初始濃度 (mol·L—1) |
OH—的初始濃度 (mol·L—1) |
初始速率v (mol·L—1· s—1) |
|
1 |
2 × 10—3 |
1.5 × 10—3 |
1.00 |
1.8 × 10—4 |
|
2 |
a |
1.5 × 10—3 |
1.00 |
3.6 × 10—4 |
|
3 |
2 × 10—3 |
3 × 10—3 |
2.00 |
1.8 × 10—4 |
|
4 |
4 × 10—3 |
3 × 10—3 |
1.00 |
7.2 × 10—4 |
已知表中初始反應速率與有關離子濃度關系可以表示為v= k [I—]1 [ClO—]b [OH—]c(溫度一定時,k為常數)。
①設計實驗2和實驗4的目的是 ;
②若實驗編號4的其它濃度不變,僅將溶液的酸堿值變更為pH = 13,反應的初始速率v= 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com