

分析 (1)氫氧燃料電池屬于原電池,是將化學能轉化為電能的裝置;燃料電池中,通入燃料的電極是負極、通入氧化劑的電極是正極,電子從負極沿導線流向正極;
(2)堿性氫氧燃料電池中,負極上氫氣失電子和氫氧根離子反應生成水;
(3)反應物接觸面積越大,反應速率越快;
(4)該電池反應時中,氮元素化合價由-3價變為0價,H元素化合價由+1價變為0價,所以生成氮氣的電極A是陽極,生成氫氣的電極B是陰極,結合電解池的工作原理分析解答.
解答 解:(1)氫氧燃料電池屬于原電池,是將化學能轉化為電能的裝置,所以該燃料電池中能量主要轉化形式是化學能轉化為電能;燃料電池中,通入燃料的電極是負極、通入氧化劑的電極是正極,電子從負極沿導線流向正極,所以通入氫氣的電極是負極、通入氧氣的電極是正極,電子流動方向為a到b,
故答案為:化學能→電能;a→b;
(2)堿性氫氧燃料電池中,負極上氫氣失電子和氫氧根離子反應生成水,電極反應式為H2-2e-+2OH-=2H2O,故答案為:H2-2e-+2OH-=2H2O;
(3)反應物接觸面積越大,反應速率越快,電極表面鍍鉑粉能增大反應物的接觸面積,所以能增大反應速率,故答案為:增大電極單位面積吸附H2和O2的分子數,增大反應速率;
(4)①該電池反應時中,氮元素化合價由-3價變為0價,H元素化合價由+1價變為0價,則氮元素被氧化,氫元素被還原,所以生成氮氣的電極A是陽極,生成氫氣的電極B是陰極,則圖1中N型半導體為負極,P型半導體為正極,故答案為:負極;
②A極為陽極,電極反應式為:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,故答案為:CO(NH2)2+8OH--6e-═CO32-+N2↑+6H2O;
③A極為陽極,電極反應式為:CO(NH2)2+80H--6e-═CO32-+N2↑+6H2O,若A極產生7.00g即0.25molN2,則轉移電子是1.5mol,此時B極產生氫氣,B電極反應為:2H2O+2e-═H2↑+2OH-,轉移1.5mol電子,產生氫氣的體積是:$\frac{1.5mol}{2}×22.4L/mol$=16.8L,故答案為:16.8.
點評 本題考查了原電池和電解池的工作原理知識,明確元素化合價變化與陰陽極的關系是解本題關鍵,根據電解池的工作原理來分析解答,難度中等.


 發散思維新課堂系列答案
發散思維新課堂系列答案科目:高中化學 來源: 題型:選擇題
| A. | Fe與稀HNO3 | B. | Na2O2與CO2 | ||
| C. | NaOH溶液與CO2 | D. | AlCl3溶液與NaOH溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醫療上可用硫酸鋇作X射線透視腸胃的內服藥,是因為硫酸鋇不溶于水 | |
| B. | 紅葡萄酒營養豐富(含葡萄糖、維生素C等),常添加微量的二氧化硫,利用二氧化硫還原性,防止紅葡萄酒中某營養成分被氧化 | |
| C. | 某雨水放置一段時間后pH由4.68變為4.28,因為水中亞硫酸被空氣中氧氣氧化成硫酸 | |
| D. | 次氯酸鈉溶液可用于環境的消毒殺菌 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

| A. | 分離Na2CO3溶液和CH3COOC2H5,選④ | B. | 用CCl4提取碘水中的碘,選③ | ||
| C. | 用溴水除去甲烷中混有的乙烯,選⑤ | D. | 粗鹽提純,選①和② |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 18.6g | B. | 20g | C. | 19.4g | D. | 24g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 實驗 | 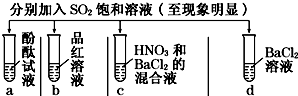 | ||||
| 記錄 | A | 無色 | 無色 | 無現象 | 無色溶液 |
| B | 紅色 | 無色 | 白色沉淀 | 白色溶液 | |
| C | 無色 | 無色 | 白色沉淀 | 無色溶液 | |
| D | 無色 | 無色 | 無色沉淀 | 無色溶液 | |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 2 | ① | ② | ||||||
| 3 | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | ||
| 4 | ⑨ | ⑩ |
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com