
| A. | 2H2(g)+O2(g)═2H2O(g);△H1 2H2(g)+O2(g)═2H2O(l);△H2 | |
| B. | S(s)+O2═SO2(g);△H1 S(g)+O2═SO2(g);△H2 | |
| C. | C(s)+$\frac{1}{2}$O2(g)═CO(g);△H1 C(s)+O2(g)═CO2(g);△H2 | |
| D. | H2(g)+Cl2(g)═2HCl(g);△H1$\frac{1}{2}$H2(g)+$\frac{1}{2}$Cl2(g)═HCl(g);△H2 |
分析 A、液態水變為氣態水的過程是吸熱過程;
B、固體硫變為氣態硫需要吸收熱量;
C、物質完全燃燒放出的熱量多余不完全燃燒;
D、化學反應方程式的系數加倍,焓變數值加倍.
解答 解:A、物質的燃燒反應是放熱的,焓變是負值,液態水變為氣態水的過程是吸熱的,所以生成氣態水放出的熱量少,則△H1>△H2,故A錯誤;
B、物質的燃燒反應是放熱的,所以焓變是負值,固體硫變為氣態硫需要吸收熱量,氣態硫燃燒放出的熱量多,則△H1>△H2,故B錯誤;
C、物質的燃燒反應是放熱的,所以焓變值是負值,C不完全燃燒放出的熱量少于完全燃燒放出的熱量,則△H1>△H2,故C錯誤;
D、化學反應方程式的系數加倍,焓變數值加倍,該化合反應是放熱的,所以焓變值是負值,△H1=2△H2,則△H1<△H2,故D正確;
故選D.
點評 本題考查了物質反應能量變化分析判斷,主要是蓋斯定律的應用,物質量不同、狀態不同、產物不同,反應的能量變化不同,題目較簡單.


科目:高中化學 來源: 題型:填空題
| 測定次數 | 第一次 | 第二次 | 第三次 |
| 初始讀數(mL) | 0.40 | 0.90 | 0.00 |
| 終點讀數(mL) | 25.05 | 21.00 | 19.90 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 鋁、鐵、銅是人類生活和生產中具有廣泛應用的三種金屬單質,高中段的學習常把它們及化合物歸結為重要的三角關系(圖1所示):請回答下列問題:
鋁、鐵、銅是人類生活和生產中具有廣泛應用的三種金屬單質,高中段的學習常把它們及化合物歸結為重要的三角關系(圖1所示):請回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
| 分類標準 | 金屬單質 | 酸性氧化物 | 堿性氧化物 | 溶液 | 膠體 | 電解質 |
| 屬于該類的物質 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 強電解質在稀溶液中全部以離子的形式存在 | |
| B. | 常溫下,電解質溶液的pH都在0~14之間 | |
| C. | 強電解質的水溶液導電性一定比弱電解質水溶液導電性強 | |
| D. | 弱電解質在水溶液中溶解度都很小 |
查看答案和解析>>
科目:高中化學 來源: 題型:多選題
| AgCl | Agl | Ag2S | |
| KSP(單位省略) | 1.8×10-10 | 1.5×10-16 | 1.8×10-50 |
| A. | 沉淀轉化的實質就是沉淀溶解平衡的移動 | |
| B. | 溶解度小的沉淀可以轉化為溶解度更小的沉淀 | |
| C. | AgCl固體在等物質的量濃度的NaCl、CaCl2 溶液中的溶解度相同 | |
| D. | 25℃時,在飽和AgCl、Agl、Ag2S溶液中,所含Ag+的濃度相同 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
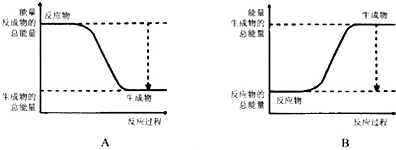 根據化學反應與能量轉化的相關知識,試回答下列問題:
根據化學反應與能量轉化的相關知識,試回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 含有共價鍵的化合物一定是共價化合物 | |
| B. | 組成單質的分子內一定含有共價鍵 | |
| C. | 由非金屬元素組成的化合物不一定是共價化合物 | |
| D. | 不同元素組成的多原子分子里的化學鍵一定為極性鍵 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com