
【題目】下列物質的用途中,不正確的是
A. 純堿:制玻璃 B. 燒堿:治療胃酸過多的一種藥劑
C. 過氧化鈉:制氧氣 D. 小蘇打:發酵粉主要成份
 期末沖刺100分創新金卷完全試卷系列答案
期末沖刺100分創新金卷完全試卷系列答案科目:高中化學 來源: 題型:
【題目】(1)實驗室用金屬銅和稀硝酸制取NO的離子方程式為______________________。
(2)NO是有毒氣體,某學生為防止污染,用分液漏斗和燒杯裝配了一套簡易的、能隨開隨用、隨關隨停的NO氣體發生裝置,如圖甲所示。

①實驗室若沒有銅絲,而只有小銅粒,在使用上述裝置進行實驗時,可用絲狀材料包裹銅粒以代替銅絲進行實驗,這種絲狀材料的成分可以是________(填序號)。
A.鐵 B.鋁 C.鉑 D.玻璃
②打開分液漏斗的活塞使反應進行,在分液漏斗中實際看到的氣體是紅棕色的,原因是__________(填化學方程式)。
(3)為證明銅絲與稀硝酸反應生成的確實是NO,某學生另設計了一套如圖乙所示的裝置制取NO。反應開始后,可以在U形管右端觀察到無色的NO氣體。
①長玻璃管的作用是______________________________________________________。
②讓反應停止的操作方法及原因是__________________________________________。
(4)以下收集NO氣體的裝置,合理的是________(填序號)。
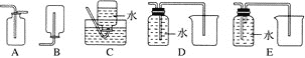
(5)將32.64 g銅與140 mL一定濃度的硝酸反應,銅完全溶解產生的NO和NO2混合氣體在標準狀況下的體積為11.2 L。請回答:
①NO的體積為________ L,NO2的體積為________ L。
②待產生的氣體全部釋放后,向溶液中加入VmLamol·L-1的NaOH溶液,恰好使溶液中的Cu2+全部轉化成沉淀,則原硝酸溶液的濃度為________ mol·L-1。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家正在研究溫室氣體CH4、CO2的轉化和利用。
(1)在Ni基催化劑的作用下,CH4和CO2反應可獲得化工原料CO和H2。
①基態Ni外圍價電子中有_________對成對電子。
②CH4、CO2、H2分子中有孤對電子的是_________.
(2)一定條件下,CH4和CO2都能與H2O形成籠狀結構(如圖所示)的水合物晶體,其相關參數如下表。CH4與H2O形成的水合物俗稱“可燃冰”。
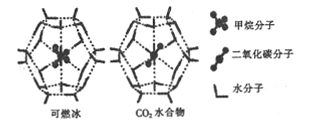
參數 分子 | 分子直徑/mm | 分子與H2O的結合能(E) |
CH4 | 0.436 | 16.40 |
CO2 | 0.512 | y |
①CO2水合物分子間存在的兩種作用力是___________.
②為開采深海海底的“可燃冰”,科學家已經證明可用CO2置換CH4。已知上圖中籠狀結構的空腔直徑為xnm,根據上述圖表,從物質的結構與性質的角度分析:x_____0.512;y_______16.40。(填“>”“<"或“=”)
③寫出CH4的一種等電子體: __________;SiO2與CO2是否互為等電子體?_________(填“是”或“不是”),理由是________.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為除去粗鹽中的鈣離子、鎂離子、硫酸根離子及泥沙等雜質,某同學設計了一種制備精鹽的實驗方案,步驟如下(用于沉淀的試劑稍過量):

(1)第①步中,操作A是__________,第⑤步中,操作B是__________。
(2)第④步中,寫出相應的化學方程式(設粗鹽溶液中Ca2+的主要存在形式為氯化鈣)____________________________。
(3)若先用鹽酸調溶液至中性,再過濾,將對實驗結果產生影響,其原因是_________________________。
(4)判斷氯化鋇已過量的方法是____________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氮化鋁(AlN)是一種新型無機材料,廣泛應用于電子、陶瓷等工業領域.在一定條件下,AlN可通過反應Al2O3+N2+3C![]() 2AlN+3CO合成.已知AlN可與NaOH溶液反應放出有刺激性氣味的氣體.下列敘述正確的是
2AlN+3CO合成.已知AlN可與NaOH溶液反應放出有刺激性氣味的氣體.下列敘述正確的是
A. 上述反應中,N2是還原劑,Al2O3是氧化劑
B. 上述反應中,每生成1molAlN需轉移6mol電子
C. AlN中氮元素的化合價為+3
D. AlN與NaOH溶液反應的化學方程式為:AlN+NaOH+H2O═NaAlO2+NH3↑
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究小組進行右圖所示實驗,試劑A為0.2mol/LCuSO4溶液,發現鋁條表面無明顯變化,于是改變實驗條件,探究鋁和CuSO4溶液、CuCl2溶液反應的影響因素。用不同的試劑A進行實驗1~實驗4,并記錄實驗現象:
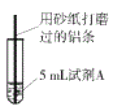
實驗序號 | 試劑A | 實驗現象 |
1 | 0.2mol/LCuCl2溶液 | 鋁條表面有氣泡產生,并有紅色固體析出 |
2 | 0.2mol/LCuSO4溶液,再加入一定質量的NaCl固體 | 開始鋁條表面無明顯變化,加NaCl后,鋁條表面有氣泡產生,并有紅色固體析出 |
3 | 2mol/LCuSO4溶液 | 鋁條表面有少量氣泡產生,并有少量紅色固體 |
4 | 2mol/LCuCl2溶液 | 反應非常劇烈,有大量氣泡產生,溶液變成棕褐色,有紅色固體和白色固體生成 |
(1)實驗1中,鋁條表面析出紅色固體的反應的離子方程式為_________。
(2)實驗2的目的是證明銅鹽中的陰離子Cl-是導致實驗1中反應迅速發生的原因,實驗2中加入NaCl固體的質量為______g。
(3)實驗3的目的是_________ 。
(4)經檢驗可知,實驗4中白色固體為CuCl。甲同學認為產生白色固體的原因可能是發生了Cu+CuCl2=2CuCl的反應,他設計了右圖所示實驗證明該反應能夠發生。
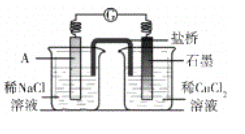
①A極的電極材料是_________。
②能證明該反應發生的實驗現象是_________ 。
(5)為探究實驗4中溶液呈現棕褐色的原因,分別取白色CuCl固體進行以下實驗:
實驗序號 | 實驗操作 | 實驗現象 |
i | 加入濃NaCl溶液 | 沉淀溶解,形成無色溶液 |
ii | 加入飽和AlCl3溶液 | 沉淀溶解,形成褐色溶液 |
iii | 向i所得溶液中加入2mol/LCuCl2溶液 | 溶液由無色變為褐色 |
查閱資料知:CuCl難溶于水,能溶解在Cl-濃度較大的溶液中,生成[CuCl2]
①由述球實驗及資料可推斷,實驗4中溶液呈棕褐色的原因可能是[CuCl2]-與_____作用的結果。
②為確證實驗4所得的棕褐色溶液中含有[CuCl2]-,應補充的實驗是_______。
(6)上述實驗說明,鋁和CuSO4溶液、CuCl2溶液的反應現象與______有關。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】可逆反應2NO2(g)![]() 2NO(g)+O2(g)在體積固定的密閉容器中進行,達到平衡狀態的標志是( )
2NO(g)+O2(g)在體積固定的密閉容器中進行,達到平衡狀態的標志是( )
①單位時間內生成n mol O2的同時生成2n mol NO2
②單位時間內生成n mol O2的同時生成2n mol NO
③用NO2、NO、O2表示的反應速率之比為2∶2∶1的狀態
④混合氣體的顏色不再改變的狀態 ⑤混合氣體的密度不再改變的狀態
⑥混合氣體的壓強不再改變的狀態 ⑦混合氣體的平均相對分子質量不再改變的狀態
A. ①④⑥⑦ B. ②③⑤⑦ C. ①③④⑤ D. 全部
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com