
氧化鐵是重要工業顏料,以廢鐵屑為原料制備氧化鐵的步驟如下:(部分操作和條件略)
步驟1:用碳酸鈉溶液洗去鐵屑表面的油污。
步驟2:加入稍過量的稀硫酸,保持50~80℃,充分反應后,過濾。
步驟3:將濾液與稍過量的NH4HCO3溶液混合,得到FeCO3的濁液。
步驟4: 、 、干燥,得到FeCO3固體。
步驟5:煅燒FeCO3,得到Fe2O3固體。
(1)步驟2中,如何判斷反應已經充分? 。
(2)步驟2所得的濾渣中主要含有一種鐵的化合物W(Fe3C),經以下處理后,回收利用:W在足量的空氣中高溫煅燒,生成有磁性的固體X;將X溶于稀硫酸。
①煅燒時1 mol W消耗O2 mol。
②X溶于稀硫酸的離子方程式為 。
(3)步驟3生成FeCO3反應的化學方程式為 。
(4)將步驟4補充完整: 、 。
(5)若煅燒時條件控制不當,會使產品中存在雜質FeO。
①若要設計實驗檢驗產品中是否存在FeO,且只能選用兩種試劑,這兩種試劑是 。
②現煅燒116.0 kg的FeCO3,得到79.2 kg產品,則該產品的純度為__________。(設產品中只有一種雜質FeO,計算結果保留3位有效數字)
科目:高中化學 來源:2015-2016學年河北省高二下期末化學試卷(解析版) 題型:選擇題
下列有關物質性質或應用的說法正確的是
A.鈉的金屬性比鉀強,工業上用鈉制取鉀(Na+KCl K↑+NaCl)
K↑+NaCl)
B.利用Al2O3制作的坩堝,可用于熔融燒堿
C.氫氟酸具有強酸性,用氫氟酸蝕刻玻璃
D.制水泥和玻璃都用石灰石作原料
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河南新鄉一中高二下期末化學試卷(解析版) 題型:選擇題
將氯氣通入一定溫度的KOH溶液中,得到含有次氯酸鉀、氯酸鉀和氯化鉀的混合溶液.若反應過程中轉移6.02×1023個電子,所得溶液中c(Cl-):c(C1O3-)=10:1,則參與反應的C12的物質的量為( )
A.0.8mo1 B.0.6mo1 C.0.5mo1 D.1.0mo1
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河南新鄉一中高二下期末化學試卷(解析版) 題型:選擇題
NaNO2是一種食品添加劑,它能致癌.酸性KMnO4溶液與NaNO2的反應方程式是:MnO4-+NO2-+H+→Mn2++NO3-+H2O(未配平)。下列敘述中正確的是( )
A.該反應中NO2-是還原劑
B.反應過程中溶液的pH減小
C.生成1mol NaNO3時消耗0.4mol KMnO4
D該反應可說明氧化性MnO4-<NO3-
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河南新鄉一中高二下期末化學試卷(解析版) 題型:選擇題
油條是我國北方的傳統食品,其做法是將明礬,堿,食鹽按比例加入溫水中,再加入面粉攪拌成面團,放置,使面團產生氣體,形成孔洞,達到柔順,放置過程發生反應:3Na2CO3+2KAl(SO4)2·12H2O=3Na2SO4+K2SO4+3CO2↑+2A1(OH)3↓+21 H2O,下列有關判斷正確的是( )
A.從物質的分類角度來看,油條配方中的“明礬、堿”均屬于鹽
B.放置過程發生的反應為氧化還原反應
C.放置過程發生的反應中反應物和生成物均為電解質
D.反應的離子方程式為:3CO32-+2KAl(SO4)2·12H2O=3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高一下期末化學試卷(解析版) 題型:選擇題
將Mg、Cu組成的26.4g混合物投入到適量的稀硝酸中,固體完全溶解,將產生的氣體和6.72L(標準狀況下)氧氣混合通入水中,恰好全部被水吸收.向反應后的溶液中加入足量4mol/L﹣1的NaOH溶液,使金屬離子完全沉淀.則形成沉淀的質量是
A.63.8 g B.53.6 g C.46.8 g D.43.2 g
查看答案和解析>>
科目:高中化學 來源:2015-2016學年江西省高一下期末化學試卷(解析版) 題型:選擇題
有A、B、C、D、E五種短周期的主族元素,其原子序數依次增大.其中只有C是金屬,D的單質是黃色固體,A、B、D在周期表中的相對位置關系如圖所示,下列說法正確的是
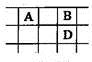
A. E元素位于周期表中的第三周期、ⅥA族
B. B的簡單陰離子比D的簡單陰離子還原性強
C. B與C形成的化合物中一定含有共價鍵
D. A、B兩元素形成的常見化合物的分子中均含有極性鍵
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北冀州中學高二上第一次月考化學試卷(解析版) 題型:選擇題
下列說法不正確的是( )
A.任何化學反應都伴隨有能量變化
B.化學平衡發生移動時,化學反應速率一定變化
C.反應物的總能量高于生成物的總能量時,發生放熱反應
D.正反應進行的程度大、正反應速率一定大。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com