
【題目】苯乙酸銅是合成優良催化劑、傳感材料﹣﹣納米氧化銅的重要前驅體之一。
如圖1是它的一種實驗室合成路線:
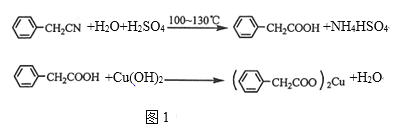
制備苯乙酸的裝置如圖2所示(加熱和夾持裝置等略):
已知:苯乙酸的熔點76.5℃,微溶于冷水,溶于熱水、乙醇。
回答下列問題
(1)在250mL三口瓶a中加入70mL70%硫酸,將a中的溶液加熱至100℃,緩緩滴加40g苯乙腈到硫酸溶液中,然后升溫至130℃繼續反應。
①在裝置中,儀器b的作用是_______。
②儀器c的名稱是_________,其作用是_______。
③反應結束后與適量冷水混合,混合的操作是_______,與冷水混合的目的是______。
(2)下列儀器中可用于分離苯乙酸粗品的是__________(填字母)。
A 分液漏斗 B 漏斗 C 燒杯 D 直形冷凝管 E 玻璃棒
(3)提純苯乙酸的方法是:將苯乙酸粗產品加入到______進行溶解,然后_____,最后____。最終得到44g純品,則苯乙酸的產率是_______。
(4)將苯乙酸加入到乙醇與水的混合溶劑中,充分溶解后,加入Cu(OH)2攪拌30min,過濾,濾液靜置一段時間,析出苯乙酸銅晶體,混合溶劑中乙醇的作用是__________。
【答案】滴加苯乙腈 球形冷凝管 使反應物冷凝回流(或使氣化的反應液冷凝) 把反應混合液沿燒杯內壁(或玻璃棒)倒入裝有冷水的燒杯中,并用玻璃棒不斷攪拌 便于苯乙酸析出 BCE 熱水中 冷卻結晶 過濾 95% 增大苯乙酸溶解度,便于充分反應
【解析】
(1)①儀器b可加入反應液;
②由圖可知,c為冷凝管,使氣化的液體冷凝回流;
③因為反應混合物中有濃硫酸,所以要將混合物倒入冷水中,反應結束后加適量冷水,降低溫度,減小苯乙酸的溶解度;
(2)分離苯乙酸粗品,利用過濾操作;
(3)苯乙酸微溶于冷水,在水中的溶解度較小,用重結晶的方法進行提純;由反應![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4可知,40g苯乙腈生成苯乙酸為40g×
+NH4HSO4可知,40g苯乙腈生成苯乙酸為40g×![]() =46.5g,根據產率=
=46.5g,根據產率=![]() ×100%計算;
×100%計算;
(4)苯乙酸微溶于冷水,溶于乙醇,混合溶劑中乙醇可增大苯乙酸的溶解度。
(1)①儀器b的作用為滴加苯乙腈;
②由圖可知,c為球形冷凝管,其作用為回流(或使氣化的反應液冷凝);
③因為反應混合物中有濃硫酸,所以要將混合物倒入冷水中,反應結束后加適量冷水,降低溫度,減小苯乙酸的溶解度,則加入冷水可便于苯乙酸析出;
(2)分離苯乙酸粗品,利用過濾操作,則需要的儀器為漏斗、燒杯、玻璃棒,故答案為BCE;
(3)苯乙酸微溶于冷水,在水中的溶解度較小,則提純苯乙酸的方法是重結晶,將苯乙酸粗產品加入到 熱水中進行溶解,然后冷卻結晶,最后過濾;由反應![]() +H2O+H2SO4
+H2O+H2SO4![]()
![]() +NH4HSO4可知,40g苯乙腈生成苯乙酸為40g×
+NH4HSO4可知,40g苯乙腈生成苯乙酸為40g×![]() =46.5g,最終得到44g純品,則苯乙酸的產率是
=46.5g,最終得到44g純品,則苯乙酸的產率是![]() ×100%=95%;
×100%=95%;
(4)苯乙酸微溶于冷水,溶于乙醇,混合溶劑中乙醇可增大苯乙酸的溶解度,然后與Cu(OH)2反應除去苯乙酸,即混合溶劑中乙醇的作用是增大苯乙酸溶解度,便于充分反應。


科目:高中化學 來源: 題型:
【題目】中央電視臺報道聯華超市在售的某品牌雞蛋為“橡皮彈”,專家介紹,這是由于雞飼料里添加了棉籽餅,從而使雞蛋里含有過多棉酚所致。其結構簡式如圖:下列說法不正確的是( )
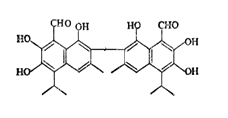
A. 該化合物的分子式為:C30H30O8
B. 1mol棉酚最多可與10mol H2加成,與6molNaOH反應
C. 在一定條件下,可與乙酸反應生成酯類物質
D. 該物質可以使酸性高錳酸鉀溶液褪色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物F是一種有機合成中間體,一種合成路線如下:
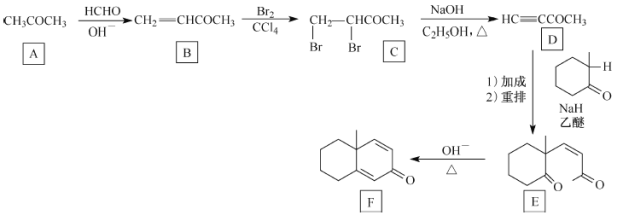
回答下列問題:
(1)A的化學名稱為_________________。
(2)B生成C的反應類型為______________,C生成D的反應類型為______________。
(3)F的分子式為_____________,F中所含官能團的名稱是____________________。
(4)化合物X與E互為同分異構體,X能與FeCl3溶液發生顯色反應,核磁共振氫譜有5組峰且面積比為9:2:2:2:l。寫出2種符合要求的X的結構簡式:______________________________。
(5)肉桂醛( ![]() )是重要的香精香料中間體,設計由苯甲醇和乙醛為起始原料制備肉桂醛的合成路線:_______________________________________________。(無機試劑任選)。
)是重要的香精香料中間體,設計由苯甲醇和乙醛為起始原料制備肉桂醛的合成路線:_______________________________________________。(無機試劑任選)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾天氣頻繁出現,嚴重影響人們的生活和健康。其中首要污染物為可吸入顆粒物PM2.5,其主要來源為燃煤、機動車尾氣等。因此,對PM2.5、SO2、NOx等進行研究具有重要意義。請回答下列問題:
(1)將PM2.5樣本用蒸餾水處理制成待測試樣。
若測得該試樣所含水溶性無機離子的化學組分及其平均濃度如下表:
離子 | K+ | Na+ | NH4+ | SO42- | NO3- | Cl- |
濃度mol/L | 4×10-6 | 6×10-6 | 2×10-5 | 4×10-5 | 3×10-5 | 2×10-5 |
根據表中數據判斷試樣的pH=________________。
(2)為減少SO2的排放,常將煤轉化為清潔氣體燃料:
已知:H2(g)+ ![]() O2(g) =H2O(g) △H= -241.8kJ·mol-1
O2(g) =H2O(g) △H= -241.8kJ·mol-1
C(s)+ ![]() O2(g) =CO(g) △H = -110.5kJ·mol-1
O2(g) =CO(g) △H = -110.5kJ·mol-1
寫出焦炭與水蒸氣反應的熱化學方程式:_________________________________________________。
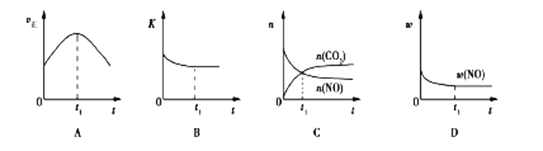
(3)汽車尾氣凈化的主要原理:2NO(g)+2CO(g)![]() 2CO2(g)+N2(g); △H<0,若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是________(填序號)。(如圖中v正、K、n、w分別表示正反應速率、平衡常數、物質的量、質量分數)
2CO2(g)+N2(g); △H<0,若該反應在絕熱、恒容的密閉體系中進行,下列示意圖正確且能說明反應在進行到t1時刻達到平衡狀態的是________(填序號)。(如圖中v正、K、n、w分別表示正反應速率、平衡常數、物質的量、質量分數)
(4)車輛排放的氮氧化物、煤燃燒產生的二氧化硫是導致霧霾天氣的“罪魁禍首”之一。活性炭可處理大氣污染物NO。在5L密閉容器中加入NO和活性炭(假設無雜質)。一定條件下生成氣體E和F。當溫度分別在T1℃和T2℃時,測得各物質平衡時物質的量(n/mol)如下表:
物質 溫度/℃ | 活性炭 | NO | E | F |
初始 | 3.000 | 0.10 | 0 | 0 |
T1 | 2.960 | 0.020 | 0.040 | 0.040 |
T2 | 2.975 | 0.050 | 0.025 | 0.025 |
①寫出NO與活性炭反應的化學方程式______________________;
②計算上述反應T1℃時的平衡常數K1=______________________;若T1<T2,則該反應的△H _____0(填“>”、“<”或“=”)。
③上述反應T1℃時達到化學平衡后再通入0.1molNO氣體,則達到新化學平衡時NO的轉化率為________;
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】實驗法是學習化學的重要方法。
Ⅰ.海帶中含有豐富的碘元素,以碘離子的形式存在。實驗室里從海藻中提取碘的流程如下(已知2I-+Cl2=2Cl-+I2,碘與溴一樣易溶于有機溶劑):
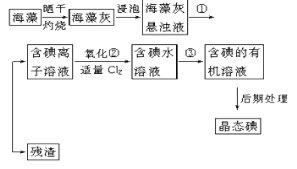
(1)實驗操作①的名稱:___。
(2)實驗步驟②中加適量Cl2的目的__。
(3)實驗步驟③提取碘的過程中,不能選用的溶劑是__。
A.苯 B.酒精 C.四氯化碳
(4)從海藻開始經過5步操作到含碘的有機溶液的實驗過程中,要用到多種實驗儀器。已知實驗室里有坩堝、坩堝鉗、燒杯、玻璃棒、酒精燈、石棉網、以及必要的夾持儀器等物品,尚缺少的玻璃儀器是___、___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】以下是一些常見物質間互相轉化的關系圖(部分反應條件已省略)。已知A、B、X、Y均為無色氣體,E、F為常見單質。
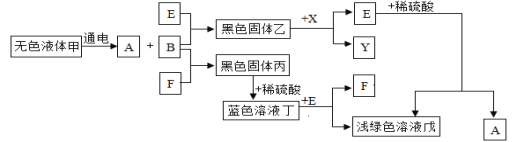
請回答:
(1)寫出下列物質的化學式:F__、戊__。
(2)寫出下列轉化的化學方程式:
①甲→A+B___;
②乙+X→E+Y___。
(3)說出藍色溶液丁中溶質的一種用途___。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下將 0. 1mol·L-1的燒堿溶液不斷滴加到 10.00 mL 相同濃度的 HA 溶液中,溶液中-lgc水 (H+)與NaOH 溶液的體積關系如圖所示[注:c水(H+)為溶液中水電離的(H+)],下列說法不正確的是
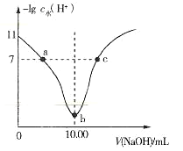
A.0.1 mol · L-1 HA 溶液pH=3
B.b 點溶液中存在:c(H+)+c(HA)=c(OH-)
C.a、b、c 三點溶液中,a 點溶液導電性最強
D.a、c 兩點溶液中均存在:c(H+)+ c(Na+) = c(OH-)+ c(A-)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用質量分數為36.2%的鹽酸(密度為1.16gcm-3)配置1.0molL-1的稀鹽酸。現實驗室需要這種稀鹽酸220mL,試回答下列問題:
(1)配置稀鹽酸時,應選用容積為___________mL的容量瓶。
(2)經計算需要___________mL濃鹽酸,在量取時宜選用下列量筒中的___________。
A.2mL B.10mL C.22mL D.20mL
(3)在量取濃鹽酸后,進行了下列操作:
①待稀釋的鹽酸的溫度與室溫一致后,沿玻璃棒注入容量瓶中。
②往容量瓶中小心加蒸餾水至液面離容量瓶刻度線12cm時,改用膠頭滴管加蒸餾水,使溶液的液面與瓶頸的刻度線相切。
③在盛鹽酸的燒杯中注入蒸餾水,并用玻璃棒攪動,使其混合均勻。
④用蒸餾水洗滌燒杯和玻璃棒2至3次,并將洗滌液全部注入容量瓶。
上述操作中,正確的是順序是(填序號)___________。
(4)在上述配制過程中,用剛剛洗滌潔凈還有少量筒來量取濃鹽酸,其配制的稀鹽酸濃度_______(填“偏高”“偏低”或“無影響”,下同)。若未用蒸餾水洗滌燒杯內壁或未將洗滌液注入容量瓶則配制的稀鹽酸濃度___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】X、Y、Z、W為原子序數依次增大的四種短周期主族元素,A、B、C、D、E為上述四種元素中的一種或幾種所組成的物質。已知A分子中含有18個電子,C、D有漂白性。五種物質間的轉化關系如圖所示。下列說法錯誤的是
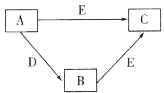
A.Y的簡單氫化物的沸點比Z的高
B.X、Y組成的化合物中可能含有非極性鍵
C.Z的氧化物對應水化物的酸性比W的弱
D.W是所在周期中原子半徑最小的元素
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com