
| 滴定次數 | 待測液體積(mL) | HCl溶液體積(mL) | |
| 滴定前讀數 | 滴定后讀數 | ||
| 第一次 | 10.00 | 0.50 | 20.51 |
| 第二次 | 10.00 | 4.00 | 24.00 |
| 第三次 | 10.00 | 5.11 | 25.10 |
分析 (1)根據實驗操作的步驟以及每步操作需要儀器確定反應所需儀器來解答,配制250mL的溶液應選用250mL的容量瓶;
(2)題中準確量取10.00mL的燒堿溶液,應選用堿式滴定管;
(3)因為石蕊的變色范圍比較大,所以通常不選作指示劑,
(4)根據滴定時,左手控制滴定管的活塞或玻璃球,右手不停地向同一方向搖動錐形瓶,兩眼注視錐形瓶中溶液顏色的變化;如溶液顏色變化且半分鐘內不變色,可說明達到滴定終點;
(5)先計算三次滴定分別用去的HCl的體積,再取其平均值,代入公式C(待測)═$\frac{c(標準)V(標準)}{V(待測)}$計算氫氧化鈉溶液濃度,計算250ml氫氧化鈉溶液中溶質NaOH的質量,計算其純度=$\frac{氫氧化鈉質量}{樣品質量}$×100%;
(6)實驗過程的誤差分析,通常以公式C(待測)═$\frac{c(標準)V(標準)}{V(待測)}$為依據,本題中C(標)和V(待)為確定的數據,V(標)會導致誤差的產生,V(標)偏大,使C(待)偏高,據此分析選項.
解答 解:(1)配制步驟有計算、稱量、溶解、冷卻、移液、洗滌、定容、搖勻等操作,一般用托盤天平稱量,用藥匙取用藥品,在燒杯中溶解,冷卻后轉移到250mL容量瓶中,并用玻璃棒引流,當加水至液面距離刻度線1~2cm時,改用膠頭滴管滴加,所以需要的儀器為:托盤天平、藥匙、燒杯、玻璃棒、250mL容量瓶、膠頭滴管,
故答案為:250mL容量瓶;
(2)氫氧化鈉溶液是堿溶液,需要用堿式滴定管準確量取10.00ml,
故答案為:堿式滴定管;
(3)用石蕊試液做指示劑,溶液有藍色變為紫色,顏色變化不明顯,不易觀察;
故答案為:①;
(4)滴定時,左手控制滴定管的活塞或玻璃球,右手不停地向同一方向搖動錐形瓶,兩眼注視錐形瓶中溶液顏色的變化;根據錐形瓶中溶液的顏色由黃色變成橙色,且30S內不變色,
故答案為:錐形瓶中溶液顏色的變化;
(5)圖表數據計算平均消耗標準溶液體積V(標準)═$\frac{20.51-0.500+24.00-4.00+25.10-5.11}{3}$═20.00mL
C(待測)═$\frac{c(標準)V(標準)}{V(待測)}$=$\frac{0.200mol/L×20.00ml}{10.00ml}$═0.4000mol•L-1,
則m═CVM═0.4000mol•L-1×0.25L×40g/mol═4.00g
ω(NaOH)═$\frac{4,00g}{5.00g}$×100%═80%,
故答案為:80%;
(6)根據C(待測)═$\frac{c(標準)V(標準)}{V(待測)}$分析:
A.酸式滴定管未用標準鹽酸溶液潤洗就直接注入標準鹽酸溶液,標準液的濃度偏小,造成V(標準)偏大,測定c(NaOH)偏大,故A符合;
B.滴定前盛放氫氧化鈉溶液的錐形瓶用蒸餾水洗凈后沒有干燥,待測液的物質的量不變,對V(標準)無影響,測定c(NaOH)無影響,故B不符合;
C.酸式滴定管在滴定前有氣泡,滴定后氣泡消失,造成V(標準)偏大,測定c(NaOH)偏大,故C符合;
D.讀取鹽酸體積時,開始仰視讀數,滴定結束時俯視讀數,造成V(標準)偏小,測定c(NaOH)偏低,故D不符合;
故答案為:AC.
點評 本題主要考查了中和滴定操作、誤差分析以及燒堿的純度的計算,難度中等,注意知識的積累,溶液配制的實驗過程和儀器分析、中和滴定注意問題是解題關鍵.


科目:高中化學 來源: 題型:解答題
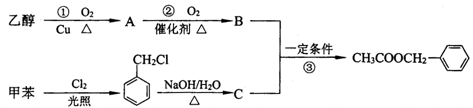
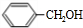 .
.查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
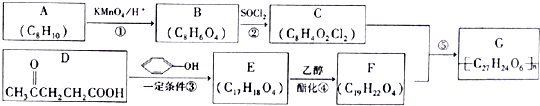
 →
→ +HCl
+HCl ;
;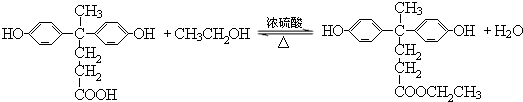 .
.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
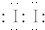 (用電子式表示).
(用電子式表示).查看答案和解析>>
科目:高中化學 來源: 題型:解答題
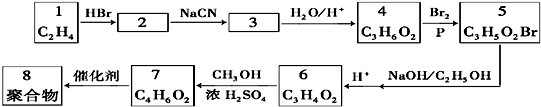

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
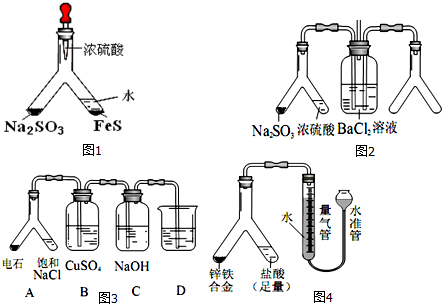
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22.4L CO | B. | 4.4g CO2 | C. | 8 g SO3 | D. | 24.5g H2SO4 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
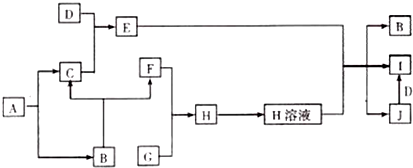
 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com