
 NH2+CHCOOH$\stackrel{△}{?}$
NH2+CHCOOH$\stackrel{△}{?}$
 +H2O
+H2O| 名稱 | 相對分子質量 | 性狀 | 密度/(g/cm3) | 熔點/℃ | 沸點/℃ | 溶解度 | |
| 苯胺 | 93 | 無色油狀液體具有還原性 | 1.02 | -6.1 | 184 | 微溶于水 | 均易溶于乙醇、乙醚 |
| 乙酸 | 60 | 無色液體 | 1.05 | 16.5 | 118 | 易溶于水 | |
| 乙酰 苯胺 | 135 | 白色晶體 | 1.22 | 114 | 304 | 微溶于冷水,溶于熱水 | |
 ,
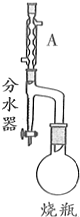
,分析 (1)儀器A為冷凝管;
(2)由于反應控制溫度在105℃左右,而沸騰的水溫度為100℃,不能達到該溫度,所以可用油浴加熱的方法;
(3)苯胺不穩定,容易被空氣中的氧氣氧化為硝基苯,為防止苯胺在反應過程中被氧化,需要加入還原劑Zn粉;
(4)水的沸點是100℃,加熱至105℃左右,就可以不斷分出反應過程中生成的水,促進反應正向進行;
(5)根據溫度計溫度下降或錐形瓶內液體不再增加可以判斷反應基本完成;
乙酰苯胺的熔點較高,稍冷即會固化,凝固在燒瓶中難易倒出;
(6)洗滌粗產品注意減少因溶解造成的損耗,結合產品的溶解性判斷,
(7)計算苯胺、乙酸的物質的量,判斷反應物過量問題,根據不足量的物質計算乙酰苯胺的理論產量,進而計算乙酰苯胺的產率.
解答 解:(1)由儀器的結構特征,控制儀器A為冷凝管,故答案為:冷凝管;
(2)由于反應控制溫度在105℃左右,而沸騰的水溫度為100℃,不能達到該溫度,所以可用油浴加熱的方法,故答案為:油浴;
(3)苯胺不穩定,容易被空氣中的氧氣氧化為硝基苯,加入還原劑Zn粉,可以防止苯胺在反應過程中被氧化,故答案為:防止苯胺在反應過程中被氧化;
(4)水的沸點是100℃,加熱至105℃左右,就可以不斷分出反應過程中生成的水,促進反應正向進行,提高生成物的產率,故答案為:不斷分出反應過程中生成的水,促進反應正向進行,提高生成物的產率;
(5)若看到溫度計溫度下降或錐形瓶內液體不再增加,就表明反應物的蒸氣較少,生成物達到了最大量,反應基本完成;
由于乙酰苯胺的熔點較高,稍冷即會固化,凝固在燒瓶中難易倒出,反應結束后須立即倒入事先準備好的冰水中,
故答案為:溫度計溫度下降或錐形瓶內液體不再增加;乙酰苯胺的熔點較高,稍冷即會固化,凝固在燒瓶中難易倒出;
(6)由于乙酰苯胺微溶于冷水,溶于熱水,易溶于乙醇、乙醚,所以洗滌粗品最合適的試劑是用少量冷水洗,以減少因洗滌造成的損耗,故選:A;
(7)n(苯胺)=(5mL×1.02g/mL)÷93g/mol=0.055mol,n(乙酸)=( 7.5mL×1.05g/ml)÷60g/mol=0.13mol,二者按1:1反應,由于乙酸的物質的量大于苯胺的物質的量,所以產生乙酰苯胺的物質的量要以不足量的苯胺為原料為標準,乙酰苯胺的理論產量為0.055mol,而實際產量n(乙酰苯胺)=1.8g÷135g/mol=0.0133mol,所以乙酰苯胺的產率為(0.0133mol÷0.055mol)×100%=24%,
故答案為:24%.
點評 本題考查有機物的合成實驗、基本操作、實驗條件的控制與分析評價等,是對學生綜合能力的考查,需要學生具備扎實的基礎,難度中等.


 寒假大串聯黃山書社系列答案
寒假大串聯黃山書社系列答案 寒假創新型自主學習第三學期寒假銜接系列答案
寒假創新型自主學習第三學期寒假銜接系列答案科目:高中化學 來源: 題型:選擇題
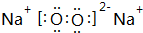
| A. | 通入Ne | B. | 通入NO2 | C. | 通入N2O4 | D. | 以上都不行 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 只有放熱的氧化還原反應才能設計成原電池,并將電能轉化為化學能 | |
| B. | 電解質溶液中陰、陽離子的定向移動,與導線中電子的定向移動共同組成了一個完整的閉合回路 | |
| C. | 無論在原電池還是在電解池中,電子均不能通過電解質溶液 | |
| D. | 原電池的負極失去電子的總數等于正極得到電子的總數 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 85L | B. | 75L | C. | 73L | D. | 70L |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 實驗室制備甲基丙烯酸甲酯的反應裝置示意圖和有關信息如下:
實驗室制備甲基丙烯酸甲酯的反應裝置示意圖和有關信息如下:
| 藥品 | 相對分子質量 | 熔點/℃ | 沸點/℃ | 溶解性 | 密度(g•cm-3) |
| 甲醇 | 32 | -98 | -64.5 | 與水混溶,易溶于有機溶劑 | 0.79 |
| 甲基丙烯酸 | 86 | 15 | 161 | 溶于熱水,易溶于有機劑 | 1.01 |
| 甲基丙烯酸甲酯 | 100 | -48 | 100 | 微溶于水,易溶于有機溶劑 | 0.944 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 利用以下實驗器材(規格和數量不限):燒杯、玻璃棒、膠頭滴管、分液漏斗,能完成用溴水和CCl4除去NaBr溶液中的少量NaI的實驗 | |
| B. | 制備硫酸亞鐵晶體時,最后在蒸發皿中蒸發濃縮溶液時,只需小火加熱至溶液被全部蒸干 | |
| C. | 向兩支盛有KI3溶液的試管中分別加入淀粉和硝酸銀溶液,前者溶液變藍后者產生黃色沉淀,由此得出KI3溶液中存在平衡I3-?I2+I- | |
| D. | 科學家在研究物質微觀結構的過程中先后使用了光學顯微鏡、電子顯微鏡、掃描隧道顯微鏡等觀測儀器 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
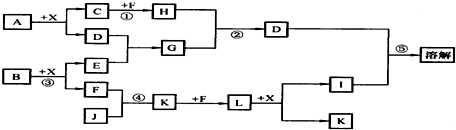
 ,
,查看答案和解析>>
科目:高中化學 來源: 題型:多選題
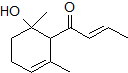 ,可用于制作香水.有關該化合物的下列說法正確的是( )
,可用于制作香水.有關該化合物的下列說法正確的是( )| A. | 分子式為C12H20O2 | B. | 該化合物可使酸性KMnO4溶液褪色 | ||
| C. | 該化合物可與NaOH溶液發生反應 | D. | 1 mol該化合物可與2 mol Br2加成 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com