
草酸合鐵(Ⅲ)酸鉀晶體Kx[Fey(C2O4)z]·nH2O可用于攝影和藍色印刷。為確定其組成,某化學興趣小組在沒有氧氣干擾下進行如下實驗:
實驗Ⅰ.草酸根含量的測定
稱取0.9820 g樣品放入錐形瓶中,加入適量稀硫酸和一定量水,加熱至343~358 K,用0.2000
mol/LKMnO4溶液滴定,滴定過程中草酸根離子轉變成CO2逸出反應容器,KMnO4轉變成Mn2+。達到滴定終點時,共消耗KMnO4溶液12.00 ml。
實驗Ⅱ.鐵含量的測定
將上述滴定過草酸根的保留液充分加熱,使淡紫紅色消失。冷卻后,調節溶液pH并加入過量的KI固體,充分反應后調節pH至7左右,滴入幾滴淀粉溶液做指示劑,用0.2500 mol·L-1 Na2S2O3標準溶液滴定至終點,共消耗Na2S2O3溶液8.00 ml。(已知:實驗Ⅱ中涉及的部分離子方程式為:I2+2S2O32-=2I-+S4O62-)
請根據上述實驗回答下列問題
(1)實驗Ⅰ在滴定過程中反應的離子方程式為 。
(2)MnO4-在酸性條件下,加熱能分解為O2,同時生成Mn2+。若實驗Ⅱ中沒有對實驗Ⅰ的保留液進
行充分加熱,則測定的Fe3+的含量將會 (填“偏高”、“偏低” 或“不變”)。
(3)實驗Ⅱ用淀粉溶液做指示劑,則滴定終點觀察到的現象為 。
(4)通過計算確定樣品晶體的組成(寫出計算過程)。
(1)2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑(2分)
(2)偏高(2分)
(3)滴下最后一滴Na2S2O3標準溶液,溶液由藍色變成無色,且半分鐘內不變色(2分)
(4)(6分)
2MnO4- ~ ~~~~5C2O42- 2S2O32- ~ I2~ 2 Fe3+
2 5 2 2
0.2×12×10-3mol n(C2O42-) 0.25×8×10-3mol n(Fe3+)
解得n(C2O42-) = 6×10-3mol (1分) n(Fe3+) = 2×10-3mol (1分)
根據電荷守恒原理:n(K+) =6×10-3mol (1分)
根據質量守恒原理m(H2O) =0.9820-39×6×10-3-56×2×10-3-88×6×10-3=0.108g
n(H2O)=6×10-3 mol (1分)
n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3 (1分)
所以化學式為:K3Fe(C2O4)3·3H2O (1分)
【解析】
試題分析:(1)高錳酸鉀具有強氧化性,能把草酸氧化生成CO2,而還原產物是Mn2+,反應的化學方程式為2MnO4-+5H2C2O4+6H+=2Mn2++8H2O+10CO2↑。
(2)若實驗Ⅱ中沒有對實驗Ⅰ的保留液進行充分加熱,則溶液中有剩余的MnO4-,MnO4-能氧化I-生成單質碘,從而導致與單質碘反應的Na2S2O3溶液的體積增加,因此使測定的Fe3+的含量將會偏高。
(3)由于單質碘遇淀粉顯藍色,所以終點時的實驗現象是滴下最后一滴Na2S2O3標準溶液,溶液由藍色變成無色,且半分鐘內不變色。
(4)根據題意并結合有關的反應方程式可知
2MnO4- ~ ~~~~5C2O42- 2S2O32- ~ I2~ 2 Fe3+
2 5 2 2
0.2×12×10-3mol n(C2O42-) 0.25×8×10-3mol n(Fe3+)
解得n(C2O42-) = 6×10-3mol n(Fe3+) = 2×10-3mol
根據電荷守恒原理:n(K+) =6×10-3mol
根據質量守恒原理m(H2O) =0.9820-39×6×10-3-56×2×10-3-88×6×10-3=0.108g
n(H2O)=6×10-3 mol
n(K+):n(Fe3+):n(C2O42-):n(H2O)=3:1:3:3
所以化學式為:K3Fe(C2O4)3·3H2O
考點:考查氧化還原反應滴定實驗的有關判斷、應用以及物質組成的有關計算


 新思維寒假作業系列答案
新思維寒假作業系列答案科目:高中化學 來源: 題型:閱讀理解
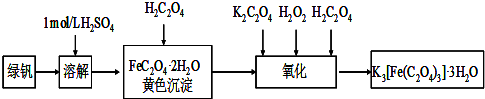
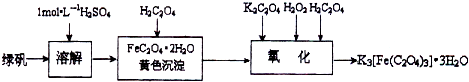
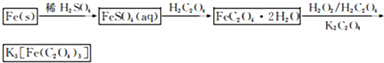
 (2013?江蘇三模)三草酸合鐵(Ⅲ)酸鉀晶體的化學式為K3[Fe(C2O4)3]?nH2O,常作為有機反應的催化劑.實驗室可用(NH4)2Fe(SO4)2?2H2O等為原料制備,實驗步驟如下:
(2013?江蘇三模)三草酸合鐵(Ⅲ)酸鉀晶體的化學式為K3[Fe(C2O4)3]?nH2O,常作為有機反應的催化劑.實驗室可用(NH4)2Fe(SO4)2?2H2O等為原料制備,實驗步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
| O | - 4 |
| O | 2- 4 |

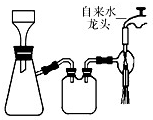
 圖所示裝置的減壓過濾與母液分離.
圖所示裝置的減壓過濾與母液分離.| O | 2- 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:閱讀理解
查看答案和解析>>
科目:高中化學 來源: 題型:
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com