
【題目】如圖所示的原電池裝置中,X,Y為兩電極,電解質溶液為稀硫酸,外電路中的電子流向如圖所示,對此裝置的下列說法正確的是( )
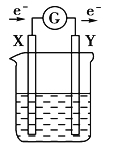
A. 外電路的電流方向為:X→外電路→Y
B. 若兩電極分別為Zn和碳棒,則X為碳棒,Y為Zn
C. 若兩電極都是金屬,則它們的活動性強弱為X>Y
D. X極上發生的是還原反應,Y極上發生的是氧化反應
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
【題目】2A(g)+B(g)3C(g)+4D(g)的反應,在不同條件下的反應的速率最快的是( )
A.v(A)=0.7 mol/(L.min)
B.v(B)=0.3mol/(L.min)
C.v(C)=0.9 mol/(L.min)
D.v(D)=1.1mol/(L.min)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在容積恒定的密閉容器中,進行如下可逆反應:A(s)+B(g)![]() 2C(g),當下列物理量不發生變化時,能表明該反應已達到平衡狀態的是( )
2C(g),當下列物理量不發生變化時,能表明該反應已達到平衡狀態的是( )
①混合氣體的密度 ②容器內氣體的壓強 ③混合氣體的總物質的量 ④B物質的量濃度
A. ①②④ B. ②③ C. ②③④ D. 全部
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一定條件下,在容積為2 L的密閉容器中加入一定量的A,發生如下的反應并建立平衡:A(g)![]() 2B(g), 2B(g)
2B(g), 2B(g)![]() C(g)+2D(g)。測得平衡時各物質的濃度是:c(A)=0.3 mol·L-1,c(B)=0.2mol·L-1,c(C)=0.05mol·L-1,則最初加入的A物質的量是( )
C(g)+2D(g)。測得平衡時各物質的濃度是:c(A)=0.3 mol·L-1,c(B)=0.2mol·L-1,c(C)=0.05mol·L-1,則最初加入的A物質的量是( )
A. 0.45mol B. 0.5mol C. 0.9mol D. 1.2mol
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】用NH3催化還原NxOy可以消除氮氧化物的污染.
已知:反應Ⅰ:4NH3(g)+6NO(g)5N2(g)+6H2O(l)△H1
反應Ⅱ:2NO(g)+O2(g)2NO2(g)△H2 (且|△H1|=2|△H2|)
反應Ⅲ:4NH3(g)+6NO2(g)5N2(g)+3O2(g)+6H2O(l)△H3
反應I和反應II在不同溫度時的平衡常數及其大小關系如表
溫度/K | 反應I | 反應II | 已知: |
298 | K1 | K2 | |
398 | K1′ | K2′ |
(1)推測反應Ⅲ是反應(填“吸熱”或“放熱”)
(2)相同條件下,反應I在2L密閉容器內,選用不同的催化劑,反應產生N2的量隨時間變化如圖所示.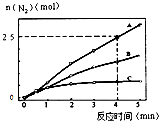
①計算0~4分鐘在A催化劑作用下,反應速率v(NO)=
②下列說法正確的是 .
A.該反應的活化能大小順序是:Ea(A)>Ea(B)>Ea(C)
B.增大壓強能使反應速率加快,是因為增加了活化分子百分數
C.單位時間內H﹣O鍵與N﹣H鍵斷裂的數目相等時,說明反應已經達到平衡
D.若在恒容絕熱的密閉容器中發生反應,當K值不變時,說明反應已經達到平衡
(3)一定條件下,反應II達到平衡時體系中n(NO):n(O2):n(NO2)=2:1:2.在其它條件不變時,再充入NO2氣體,分析NO2體積分數﹣﹣φ(NO2)的變化情況:(填“變大”、“變小”或“不變”)恒溫恒壓容器,φ(NO2);恒溫恒容容器,φ(NO2) .
(4)一定溫度下,反應III在容積可變的密閉容器中達到平衡,此時容積為3L,c(N2)與反應時間t變化曲線X如圖所示,若在t1時刻改變一個條件,曲線X變為曲線Y或曲線Z.則: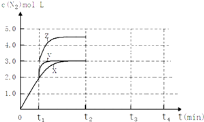
①變為曲線Y改變的條件是 . 變為曲線Z改變的條件是
②若t2降低溫度,t3達到平衡,請在圖中畫出曲線X在t2﹣t4內 c(N2)的變化曲線.
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】a、b、c、d、e、f是前四周期原子序數依次增大的6種元素,a元素的基態原子核外s能級上的電子數是p能級上電子數的2倍;c元素原子的最外層電子數是次外層電子數的3倍;d是地殼中含量最高的金屬元素;e的正三價基態離子的d能級為半充滿結構;f的基態原子最外層只有一個電子,且內層電子排布均為全充滿結構。
(1)b元素基態原子的價電子排布圖為________。
(2)a、b、c三種元素的第一電離能由大到小的順序為_________。(用元素符號回答)
(3)b與c組成的一種分子甲中有16個價電子,甲分子與______(填寫一種物質的分子式)是等電子體,甲分子中σ鍵和π鍵的數目比是______。
(4)c的氫化物中,電子總數為18的分子是乙,乙中c原子的雜化方式為_______。它是______分子(填“極性”或“非極性”)
(5)已知c、f能形成兩種化合物,其晶胞如圖所示,甲的化學式為_________。高溫時,甲易轉化為乙的原因為_________。

(6)e元素對應的單質在形成晶體時,采用如圖所示的堆積方式_________。則這種堆積模型的配位數為,如果e的原子半徑為 r pm;阿伏伽德羅常數的值為NA,計算此單質的密度表達式為_______g/cm3。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】常溫下,向20.00mL0.100mol·L-1NH4Cl溶液中逐滴加入0.100 mol·L-1NaOH溶液,溶液的pH與NaOH溶液所加入體積的關系如圖所示(不考慮揮發)。下列說法正確的是

A. 點①所示溶液中:c(Na+)=c(Cl-)>c(H+)=c(OH-)
B. 點②所示溶液中:c(Cl-)>c(Na+)>c(NH4+)>c(NH3·H2O)
C. 點③所示溶液中:c(Cl-)>c(NH3·H2O)>c(OH-)>c(NH4+)
D. 整個過程中可能出現:c(OH-)+c(Cl-)= c(NH4+)+c(NH3·H2O)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】苯是重要的有機化工原料。下列關于苯的性質說法正確的是( )
A. 常溫常壓下為氣體 B. 能發生氧化反應 C. 不能發生取代反應 D. 易溶于水
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com