

| 滴定前 | 第一次終點 | 第二次終點 | 第三次終點 | |
| 滴定管 液面刻度 | 0.00mL | 16.02mL | 16.00mL | 16.01mL |
分析 (1)在后面的試驗中要驗證CO的存在,需要用NaOH溶液把二氧化碳除掉;
(2)①利用二氧化碳能使澄清石灰水變渾濁的性質來檢驗;
②利用CO和CuO反應生成二氧化碳的性質,來檢驗二氧化碳的存在,從而證明CO的存在;
(3)Cu與稀硫酸不反應,Cu2O溶于稀硫酸生成銅單質和硫酸銅;
(4)①KMnO4和草酸鈉在稀硫酸中反應生成硫酸鉀、硫酸錳、二氧化碳和水;根據方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O計算;
②假設KMnO4溶液的濃度為c,根據方程式2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O計算.
解答 解:(1)在后面的試驗中要驗證CO的存在,需要用NaOH溶液把乙二酸晶體受熱分解生成的二氧化碳除掉;
故答案為:吸收乙二酸晶體受熱分解生成的二氧化碳;
(2)①二氧化碳通入裝置B中,澄清石灰水變渾濁,說明有二氧化碳生成;
故答案為:裝置B中澄清石灰水變渾濁;
②CO和CuO反應生成二氧化碳,二氧化碳使裝置G中澄清石灰水變渾濁,先驗證A中產生的二氧化碳被NaOH吸收完全,即裝置D中澄清石灰水不變渾濁,裝置F中黑色氧化銅變為紅色固體,裝置G中澄清石灰水變渾濁;
故答案為:裝置D中澄清石灰水不變渾濁,裝置F中黑色氧化銅變為紅色固體,裝置G中澄清石灰水變渾濁;
(3)Cu與稀硫酸不反應,Cu2O溶于稀硫酸生成銅單質和硫酸銅,則取少量固體與試管中,加稀硫酸,若溶液變藍色,說明有Cu2O,若溶液不變色,則不含有Cu2O;
故答案為:取少量固體與試管中,加稀硫酸,若溶液變藍色,說明有Cu2O,若溶液不變色,則不含有Cu2O;
(4)①KMnO4和草酸鈉在稀硫酸中反應生成硫酸鉀、硫酸鈉、硫酸錳、二氧化碳和水,則反應的離子方程式為:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
故答案為:2MnO4-+5C2O42-+16H+=2Mn2++10CO2↑+8H2O;
②根據三次試驗數據計算高錳酸鉀溶液體積平均值為=$\frac{16.02+16.0+16.01}{3}$=16.01mL,假設KMnO4溶液的濃度為c,n(C2O42-)=$\frac{0.2000g}{134g/mol}$,
則:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
2mol 5mol
c×0.01601L $\frac{0.2000g}{134g/mol}$
解得c=$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.
故答案為:$\frac{0.2000g×2mol}{5mol×134g/mol×0.01601L}$.
點評 本題以已二酸的分解為背景考查了實驗方案設計、氧化還原反應滴定、化學計算等,題目較為綜合且具有一定難度,做題時注意把握常見物的性質及檢驗方法,側重于考查學生的實驗探究能力和計算能力,題目難度中等.


科目:高中化學 來源: 題型:解答題
 .
.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | △H>0,△S>0 的反應任何條件都是非自發反應 | |
| B. | 放熱反應均能自發進行,且反應放出的熱量越多,反應越完全 | |
| C. | 某反應的△H>0、△S<0,則該反應一定不能正向進行 | |
| D. | 水從固態→液態→氣態的變化過程中△S>0 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 根據酸分子中含有的H原子個數將酸分為一元酸、二元酸、多元酸 | |
| B. | 酸性氧化物都是非金屬氧化物 | |
| C. | Na2O熔融狀態下能導電,所以Na2O是電解質 | |
| D. | 膠體區別于其他分散系的本質特征是產生丁達爾效應 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題

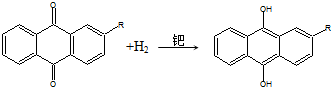
| A. | H2O2可用作漂白劑、消毒劑,也可作為火箭燃料 | |
| B. | H2O2可使濕潤的KI淀粉試紙變藍 | |
| C. | 蒽醌氧化法生產H2O2的實際結果是H2和O2生成H2O2 | |
| D. | H2O2化學性質穩定,便于儲存和運輸 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c (H+)>10-7 mol/L>c (OH-) pH<7 顯中性 | |
| B. | c (H+)=c (OH-)>10-7 mol/L pH<7 顯中性 | |
| C. | c (H+)>10-7 mol/L>c (OH-) pH<7 顯酸性 | |
| D. | c (H+)=c (OH-)>10-7 mol/L pH=7 顯中性 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H2Y的電離方程式:H2Y?2H++Y2- | |
| B. | HY- 離子水解的離子方程式:HY-+H2O?H2Y+OH- | |
| C. | 該酸式鹽溶液中離子濃度大小關系:c(Na+)>c(HY-)>c(OH-)>c(H+) | |
| D. | 該酸式鹽溶液中離子濃度關系:c(H+)+c(H2Y)═c(OH-)+c(Y2-) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 干冰和金剛石 | B. | K2CO3和KCl | C. | Na2O和Na2O2 | D. | H2SO4和HCl |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com