
| A. | x+y>3 | |
| B. | 反應速率加快,活化分子百分數增加 | |
| C. | A的轉化率減小,體積分數增大 | |
| D. | 平衡正向移動,平衡常數增大 |
分析 平衡時測得A的濃度為0.6mol?L-1,保持溫度不變,將容器的容積縮小到原來的一半,如平衡不移動,則A的濃度應為1.2mol/L,而此時為1mol/L,則說明增大壓強平衡向正方向移動,以此進行判斷.
解答 解:平衡時測得A的濃度為0.6mol?L-1,保持溫度不變,將容器的容積縮小到原來的一半,如平衡不移動,則A的濃度應為1.2mol/L,而此時為1mol/L,則說明增大壓強平衡向正方向移動,
A、增大壓強平衡向正方向移動,說明反應物氣體的計量數之和大于生成物氣體的計量數,應為x+y>3,故A正確;
B、增大壓強,單位體積化活分子數增加,而百分數不變,故B錯誤;
C、增大壓強平衡向正方向移動,說明A的轉化率增大,體積分數減少,故C錯誤;
D、平衡常數是溫度的函數,溫度不變、平衡常數不變,故D錯誤;
故選A.
點評 本題考查化學平衡移動知識,題目難度不大,注意從濃度的變化的角度判斷平衡移動的方向,結合壓強對平衡移動的影響分析.


科目:高中化學 來源: 題型:解答題
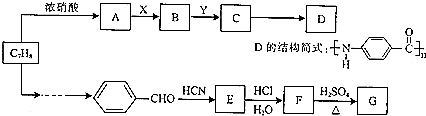
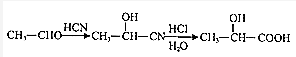
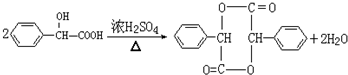 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 亞硫酸是SO2與水反應的產物,顯酸性 | |
| B. | SO2溶于水,劇烈反應生成亞硫酸 | |
| C. | 亞硫酸具有漂白性,能夠使品紅溶液褪色 | |
| D. | 亞硫酸不穩定,容易分解為水和SO2 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 實驗操作 | 現象 | 結論 |
| A | 加熱蒸干TiCl4溶液 | 產生大量固體 | 固體成分為TiCl4 |
| B | 用雙氧水滴定KI淀粉溶液 | 溶液變藍 | 達到滴定終點 |
| C | 將K3[Fe(CN)6]溶液滴加到某溶液中 | 產生藍色沉淀 | 該溶液中含有Fe2+ |
| D | 將SO2通入石蕊溶液中 | 溶液褪色 | SO2具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| 弱酸 | HCOOH | HCN | H2CO3 |
| 電離平衡常數 ( 25℃) | Ki=1.77×10-4 | Ki=5.0×10-10 | Ki1=4.3×10-7 Ki2=5.6×10-11 |

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
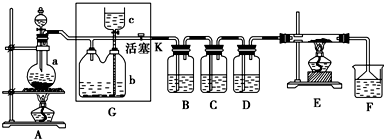
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
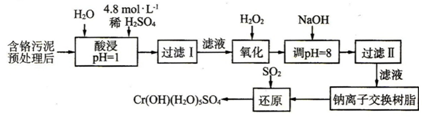
| 陽離子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
| 開始沉淀時的pH | 1.9 | 7.0 | ─ | ─ | 4.7 | ─ |
| 沉淀完全時的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com