
(10分)右面是某化工廠從海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及綜合利用的生產流程簡圖: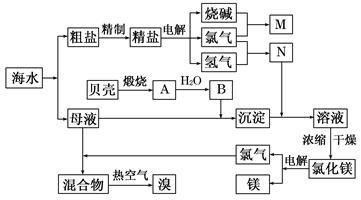
(1)在粗鹽中含有Ca2+、Mg2+、SO42-等雜質,精制時所用的試劑為:
A.鹽酸 B.氯化鋇溶液 C.氫氧化鈉溶液 D.碳酸鈉溶液。則加入試劑的順序是(填編號) 。
(2)目前工業上主要采用離子交換膜法電解飽和食鹽水,敘述錯誤的是 。
A.精制飽和食鹽水進入陽極室
B.純水(加少量NaOH)進入陰極室
C.陰極產物為氫氧化鈉和氫氣
D.電解槽的陽極用金屬鐵網制成
(3)寫出電解飽和NaCl溶液的離子反應方程式: 。
(4)利用MgCl2· 6H2O可制得無水氯化鎂,應采取的措施是 。
(5)用熱空氣吹出的溴蒸氣可以用亞硫酸鈉溶液吸收,寫出反應的化學方程式:
。
(1)BDCA 或 CBDA 或BCDA等 (2)D
(3)2Cl—+2H2O==Cl2↑+H2↑+2OH—
(4)在HCl氣流中加熱脫水(防止MgCl2水解)
(5)H2O+Na2SO3+Br2==Na2SO4+2HBr或H2O+Na2SO3+Br2="=2NaBr" +H 2SO4
解析試題分析:(1)、氯化鋇溶液用于除去SO42-,碳酸鈉溶液用于除去Ca2+、Mg2+,氫氧化鈉溶液用于進一步除去Mg2+,鹽酸用于除去上一步殘留的氫氧化鈉。
(2)、精制的飽和食鹽水進入陽極室;純水(加入一定量的NaOH溶液)加入陰極室,通電后H2O在陰極表面放電生成H2,Na+則穿過離子膜由陽極室進入陰極室,此時陰極室導入的陰極液中含有NaOH;Cl-則在陽極表面放電生成Cl2。電解后的淡鹽水則從陽極室導出,經添加食鹽增加濃度后可循環利用 ;電解槽的陽極材料若為Fe則會發生氧化反應,干擾主反應,應為石墨電極(惰性電極)
(3)、電解飽和食鹽水原理應為:2NaCl+2H2O==Cl2↑+H2↑+2NaOH,改寫成離子方程式為:2Cl—+2H2O==Cl2↑+H2↑+2OH—
(4)、加熱時MgCl2會發生水解,故應在HCl氣流中加熱脫水
(5)、Na2SO3被氧化為Na2SO4,Br2被還原為Br- ,H2O+Na2SO3+Br2==Na2SO4+2HBr
考點:電解飽和食鹽水
點評:本題屬于常規型的工藝流程題目,涉及到的化學反應都比較簡單,難點在于將化學原理與生產裝置聯系起來,分析裝置的目的以及可行性。


 陽光考場單元測試卷系列答案
陽光考場單元測試卷系列答案 名校聯盟沖刺卷系列答案
名校聯盟沖刺卷系列答案 名校提分一卷通系列答案
名校提分一卷通系列答案科目:高中化學 來源:2014屆重慶市高二12月月考化學試卷(解析版) 題型:填空題
(10分)右面是某化工廠從海水中提取NaCl、Mg(以MgCl2形式存在)和Br2(以NaBr的形式存在)及綜合利用的生產流程簡圖:
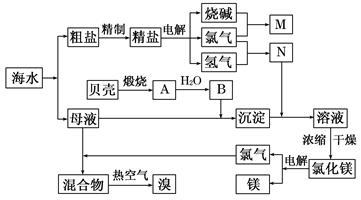
(1)在粗鹽中含有Ca2+、Mg2+、SO42-等雜質,精制時所用的試劑為:
A.鹽酸 B.氯化鋇溶液 C.氫氧化鈉溶液 D.碳酸鈉溶液。則加入試劑的順序是(填編號) 。
(2)目前工業上主要采用離子交換膜法電解飽和食鹽水,敘述錯誤的是 。
A.精制飽和食鹽水進入陽極室
B.純水(加少量NaOH)進入陰極室
C.陰極產物為氫氧化鈉和氫氣
D.電解槽的陽極用金屬鐵網制成
(3)寫出電解飽和NaCl溶液的離子反應方程式: 。
(4)利用MgCl2· 6H2O可制得無水氯化鎂,應采取的措施是 。
(5)用熱空氣吹出的溴蒸氣可以用亞硫酸鈉溶液吸收,寫出反應的化學方程式:
。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com