
【題目】運用元素周期律研究元素及其化合物的性質具有重要的意義。
I.部分短周期主族元素的最高價氧化物對應的水化物(濃度均為0.01mol.L-1)溶液的pH和原子序數的關系如圖所示。

(1)元素R在周期表中的位置是______________;元素Z的原子結構示意圖是__________。
(2)元素Y和W形成的Y2W2型化合物中含有化學鍵的類型為_____________。
II.短周期元素C、O、S能形成多種化合物,如CO2、CS2、COS等。
(1)下列能說明碳、硫兩種元素非金屬性相對強弱的是____________(填序號)
A. S與H2發生化合反應比C與H2化合更容易
B.酸性:H2SO3 >H2CO3
C.CS2中碳元素為+4價,硫元素為-2價
(2)鉛(Pb)、錫(Sn)、鍺(Ge)與元素C同主族。常溫下其單質在空氣中,錫、鍺不反應,而鉛表面會生成一層氧化鉛;鍺與鹽酸不反應,而錫與鹽酸反應。由此可得出以下結論:
①鍺的原子序數為__________________。
②它們+4價氫氧化物的堿性由強到弱順序為_________________(填化學式)。
(3)羰基硫(COS)可作為一種熏蒸劑,能防止某些昆蟲、線蟲的危害,其分子結構和CO2相似。用電子式表示羰基硫(COS)的形成過程:________________________。
【答案】 第三周期第VIIA族 P原子的結構示意圖 離子鍵、共價鍵。 AC 32 Pb(OH)4>Sn(OH)4>Ge(OH)4 略COS的電子形成過程
【解析】I.據題意X、Y、Z、W、R是短周期主族元素且原子序數依次增大,最高價氧化物對應的水化物(濃度均為0.01mol.L-1)溶液的pH,Y對應pH=12,說明Y是鈉,X對應pH=2,X是氮,Z對應pH>2,所以 Z 是磷,W對應pH<2,所以W是S;R對應pH=2原子序數最大,所以R是Cl。(1)元素R在周期表中的位置是:第三周期第ⅦA族。P的原子序數是15,原子結構示意圖為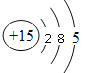 ;(2)元素Y和W形成的Y2W2型化合物是Na2S2中含有化學鍵的類型為:離子鍵、非極性共價鍵。
;(2)元素Y和W形成的Y2W2型化合物是Na2S2中含有化學鍵的類型為:離子鍵、非極性共價鍵。
II.(1)A.非金屬性越強,氫化物越穩定,S與H2發生化合反應比C與H2化合更容易,則能說明碳與硫兩元素非金屬性相對強弱關系為:S>C,a正確;B.酸性:H2SO3 >H2CO3,亞硫酸不是最高價含氧酸,不能說明碳與硫兩元素非金屬性相對強弱,b錯誤;C、直接說明S的非金屬性強于C,所以S才顯負價,碳元素顯示正價,C正確。答案選AC;(2)①鍺位于硅的下一周期,則鍺的原子序數為14+18=32。 ②同主族自上而下非金屬性逐漸減弱,金屬性逐漸增強,所以它們+4價氫氧化物的堿性由強到弱順序為Pb(OH)4>Sn(OH)4>Ge(OH)4 ;(3)羰基硫(COS)的結構和CO2相似,則其形成過程可以表示為![]() 。
。


科目:高中化學 來源: 題型:
【題目】丙酸乙酯具有菠蘿香味,用作配制朗姆酒,可通過下圖進行合成(部分反應條件略去):

回答下列問題:
(1)CH3CH2OH中官能團的名稱是____,反應②的反應類型是____。
(2)反應①是加成反應,物質X的分子式是____,
有機物A的分子式是C3H5N,其結構簡式是____,
反應③的化學反應方程式為____。
(3)除去丙酸乙酯中CH3CH2COOH和CH3CH2OH的方法是:加適量的____(填適宜的試劑)充分振蕩、靜置、分液。
(4)反應③有多種副產物,其中一種副產物M的相對分子質量為74,氧的質量分數為21.6%,n(C):n(H)=2:5,則M的分子式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】高溫下超氧化鉀晶體呈立方體結構,晶體中氧的化合價部分為0價,部分為-2價。如右圖所示為超氧化鉀晶體的一個晶胞(晶體中最小的重復單元),則下列說法中正確的是

A.超氧化鉀的化學式為KO2,每個晶胞含有4個K+和4個O2-
B.晶體中每個K+周圍有8個O2-,每個O周圍有8個K+
C.晶體中與每個K+距離最近的K+有8個
D.晶體中,0價氧與-2價氧的數目比為2:1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硼及其化合物在工農業生產中應用廣泛。
(1)基態硼原子的核外電子排布式為__________,有_______種不同能量的電子。
(2)BF3溶于水后.在一定條件下可轉化為H3O+·[B(OH)F3]-,該物質中陽離子的空間構型為_____________,陰離子的中心原子軌道采用________雜化;Cu2+也易和NH3形成配離子,已知NF3與NH3的空間構型都是三角錐形,但NF3不易與Cu2+形成配離子,其原因是_________________________________________________。
(3)與BH4-互為等電子體的分子是_______________(寫化學式)。
(4)EminBF4的熔點為12 ℃,在常溫下為液體,由有機物陽離子[Emin]+和[BF4]-構成。該物質的晶體屬于_________晶體。
(5)與硼同主族的Ga可與As形成 GaAs晶體,該晶體的熔點為1238℃,密度為ρg·cm-3,其晶胞結構如圖所示。該晶體的類型為________________。Ga和As的摩爾質量分別為MGa g·mol-1 和MAs g·mol-1,原子半徑分別為rGa pm和rAs pm,阿伏伽德羅常數值為NA,則GaAs晶胞中原子的體積占晶胞體積的百分率為____________________。

查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列溶液中C1﹣的物質的量濃度最大的是( )
A.250 mL 1 molL﹣1A1Cl3溶液 B.1000 mL 2.5 molL﹣1NaCI溶液
C.200 mL 2 molL﹣1MgCl2溶液 D.300 mL 3.5 molL﹣1KCl溶液
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】維生素C又稱“抗壞血酸”,能幫助人體將食物中攝取的不易吸收的Fe3+轉變為易吸收的Fe2+ , 這說明維生素C( )
A.具有氧化性
B.具有還原性
C.既有氧化性,又有還原性
D.具有酸性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列實驗設計可行的是( )
A.將O2和H2的混合氣體通過灼熱的氧化銅,以除去其中的H2
B.加鹽酸后過濾,除去混在銅粉中的少量鎂粉和鋁粉
C.用萃取的方法分離汽油和煤油
D.用溶解、過濾的方法分離KNO3和NaCl固體混合物
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海洋資源的利用具有廣闊前景。
(1)無需經過化學變化就能從海水中獲得的物質是(______)(填序號)。
A.Cl2 B.淡水 C.燒堿 D.食鹽
(2)下圖是從海水中提取鎂的簡單流程。

①操作A是 _______________________。
②無水MgCl2在熔融狀態下,通電后會產生Mg和Cl2,該反應的化學方程式為_____。
③海水提鎂的過程,為什么要將海水中的氯化鎂轉變為氫氧化鎂,再轉變為氯化鎂?____。
(3)海帶灰中富含以I-形式存在的碘元素。實驗室提取I2的途徑如下所示:

①灼燒海帶至灰燼時所用的主要儀器名稱是(________)(填序號)。
a.坩堝 b.試管 c.蒸發皿 d.燒杯
②向酸化的濾液中加過氧化氫溶液,寫出該反應的離子方程式________________。
③用CCl4提取碘時除了用CCl4還可以選用的試劑是(________)(填字母序號)。
a.苯 b.乙醇 c.乙酸
④為檢驗用CCl4提取碘后的水溶液中是否還含有碘單質。請寫出該實驗的實驗步驟、現象及結論:_______。
(4)利用海底的“可燃冰”制作的燃料電池的總反應式為CH4+2O2+2KOH = K2CO3+3H2O,則該燃料電池的負極的電極反應為__________________。
(5)海底的煤經綜合利用開發的副產物CO2能生產甲醇燃料,其反應的方程式為:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。某科學實驗將6 mol CO2和8 mol H2充入2 L的密閉容器中,測得H2的物質的量隨時間變化如圖實線所示。a,b,c,d括號內數據表示坐標。
CH3OH(g)+H2O(g)。某科學實驗將6 mol CO2和8 mol H2充入2 L的密閉容器中,測得H2的物質的量隨時間變化如圖實線所示。a,b,c,d括號內數據表示坐標。

①a點正反應速率_________(填“大于、等于或小于”)a點逆反應速率。
②平衡時CO2的物質的量濃度是___________mol/L。
③能夠說明該反應達到化學平衡狀態的標志是_______(雙選)。
A.單位時間內消耗1molCO2,同時生成3mol H2
B.混合氣體的密度不隨時間變化
C.CH3OH、H2的濃度不再隨時間變化
D.CH3OH和H2O濃度相等
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com