
下列指定反應的離子方程式正確的是( )
A.向稀HNO3中滴加Na2SO3溶液:2H++SO32-=SO2↑+H2O
B.向Al2(SO4)3溶液中加入過量的NaOH溶液:Al3++3OH-=Al(OH)3↓
C.用高錳酸鉀標準溶液滴定草酸:2MnO4-+16H++5C2O42-=2Mn2++10CO2↑+8H2O
D.向0.1mol/LpH=1的KHA溶液中加入KOH溶液:H++OH-=H2O
科目:高中化學 來源:2017屆河北省高三上學期一調考試化學試卷(解析版) 題型:選擇題
某些保健品中含有的鍺元素(Ge)位于周期表的第四周期IVA族。有關鍺的敘述不正確的是( )
A. 鍺的原子序數為24 B. 鍺的金屬活動性應比硅強
C. Ge可以生成化學式為Na2GeO3的鹽 D. 單質鍺是半導體材料
查看答案和解析>>
科目:高中化學 來源:2017屆湖北省松滋市高三上學期9月月考化學試卷(解析版) 題型:選擇題
下列說法不正確的是
A.使元素的化合態轉化成游離態的過程可能是還原的過程
B.高爐煉鐵的原料有鐵礦石、焦炭和空氣。工業上就是用焦炭還原鐵礦石以制得生鐵
C.電解熔融氧化鋁時,每還原出2.7kg鋁,必有300mol電子轉移
D.工業上常用電解熔融NaCl的方法制取金屬鈉
查看答案和解析>>
科目:高中化學 來源:2017屆黑龍江省大慶市高三上學期第一次模擬考試化學試卷(解析版) 題型:填空題
亞鐵氰化鉀K4[Fe(CN)6],俗名黃血鹽,可溶于水,不溶于乙醇。在化學實驗、電鍍、食品添加劑、燒制青花瓷時可用于繪畫等方面有廣泛用途。已知HCN是一種極弱的酸,現有一種用含NaCN的廢水合成黃血鹽的主要工藝流程如下:
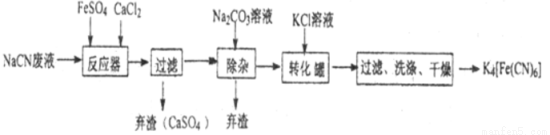
(1)常溫下,NaCN水溶液的pH 7(填“>”、“<”、“ = ”),實驗室用NaCN固體配制NaCN溶液時,應先將其溶于 溶液,再用蒸餾水稀釋。
(2)反應器中發生的主要反應的化學方程式為 。
(3)流程中加入Na2CO3溶液后過濾除去棄渣,過濾需要的玻璃儀器有燒杯、漏斗、 。
(4)轉化器中生成K4[Fe(CN)6]的反應類型是 ,相同溫度下,溶解度:K4[Fe(CN)6] Na4[Fe(CN)6](填“>”“ = ”“<”),過濾后洗滌K4[Fe(CN)6]使用的試劑是 。
(5)實驗室常用K4[Fe(CN)6]檢驗Fe3+,生成難溶鹽KFe[Fe(CN)6],試寫出上述反應的離子方程式為 。
(6)含有14.7kgNaCN的工業廢水可生產出9.2kg的K4[Fe(CN)6],則K4[Fe(CN)6]的產率是 。
查看答案和解析>>
科目:高中化學 來源:2017屆黑龍江省大慶市高三上學期第一次模擬考試化學試卷(解析版) 題型:選擇題
下列有關電解質溶液的說法正確的是( )
A.KCl溶液和CH3COONH4溶液均顯中性,兩溶液中水的電離程度相同
B.向氟化鈉溶液中加入適量氫氟酸,得到的酸性混合溶液:c(Na+)>c(F-)>c(H+)>c(OH-)
C.25℃時,等體積pH=3的HA和HB兩種酸分別與足量的鋅反應,相同時間內HA與Zn反應生成的氫氣更多,HA是弱酸
D.Na2CO3溶液中加入少量Ca(OH)2固體,CO32-水解程度減小,溶液的pH減小
查看答案和解析>>
科目:高中化學 來源:2017屆西藏日喀則區第一高級中學高三上第一次月考化學卷(解析版) 題型:填空題
Ⅰ、在淀粉KI溶液中加入少量NaClO溶液,并加入少量硫酸,溶液立即變藍,所發生的離子方程式是 ,在上述藍色溶液中滴加足量的Na2SO3溶液,現象是 ___ ,所發生的離子方程式是 。
Ⅱ、下面是你熟悉的物質:① O2 ②金剛石 ③ NaBr ④H2SO4 ⑤ Na2CO3 ⑥ Na2S ⑦ NaHSO4 這些物質中,只含共價鍵的是_______________;只含離子鍵的是_______________;既含共價鍵又含離子鍵的是_____________(以上填序號)
查看答案和解析>>
科目:高中化學 來源:2017屆吉林省高三上學期9月月考化學試卷(解析版) 題型:填空題
取少量Fe2O3粉末(紅棕色)加入適量鹽酸,發生反應的化學方程式: 。
用此溶液分別做如下實驗:
(1)取少量溶液置于試管中,滴入幾滴NaOH溶液,可觀察到有紅褐色沉淀生成,反應的化學方程式為 ,此反應屬于 (填反應類型)。
(2)在小燒杯中加入20 mL蒸餾水,加熱至沸騰后,向沸水中滴入幾滴飽和FeCl3溶液,繼續煮沸至溶液呈 色,即制得Fe(OH)3膠體。
(3)取另一只小燒杯也加入20 mL蒸餾水,向燒杯中加入1 mL FeCl3溶液,振蕩均勻后,將此燒杯(編號甲)與盛有Fe(OH)3膠體的燒杯(編號乙)一起放置于暗處,分別用激光筆照射燒杯中的液體,可以看到 燒杯中的液體產生丁達爾效應。這個實驗可以用來區別 。
(4)用Fe(OH)3膠體進行下列實驗:向其中滴入過量稀硫酸,現象是
查看答案和解析>>
科目:高中化學 來源:2017屆湖南省高三上學期9月月考化學試卷(解析版) 題型:選擇題
相同溫度下,體積均為0.25L的兩個恒容密閉容器中發生可逆反應:N2(g)+ 3H2(g)=2NH3(g) △H=-92.6 kJ·mol-1。實驗測得起始、平衡時的有關數據如下表所示:( )
容器 編號 | 起始時各物質物質的量/mol | 達平衡時體系 能量的變化 | ||
N2 | H2 | NH3 | ||
① | 1 | 3 | 0 | 放出熱量:23.15kJ |
② | 0.9 | 2.7 | 0.2 | 放出熱量:Q |
下列敘述錯誤的是
A.容器①、②中反應的平衡常數相等
B.平衡時,兩個容器中NH3的體積分數均為1/7
C.容器②中達平衡時放出的熱量Q=23.15kJ
D.若容器①體積變為0.5L,則平衡時放出的熱量小于23.15kJ
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com