
化學與材料、能源、環境等密切聯系。下列說法不正確的是
A.研發光電轉換材料,充分利用太陽能
B.包裝材料聚氯乙烯屬于烴,會造成環境污染
C.用石灰對煤燃燒形成的煙氣脫硫,并回收石膏
D.研發高效生物生長調節劑,減少對化肥的使用
科目:高中化學 來源:2016屆天津市和平區高三第二次模擬考試化學試卷(解析版) 題型:選擇題
恒溫恒容下,向2 L密閉容器中加入MgSO4(s)和CO(g),發生反應:
MgSO4(s)+CO(g) MgO(s)+CO2(g)+SO2(g),反應過程中測定的部分數據見下表:
MgO(s)+CO2(g)+SO2(g),反應過程中測定的部分數據見下表:
反應時間/min | n(MgSO4)/mol | n(CO)/mol | n(SO2)/mol |
0 | 2.0 | 2.0 | 0 |
2 | 0.8 | ||
4 | 1.2 | ||
6 | 1.2 | 2.8 |
下列說法正確的是( )。
A.0~2 min內的平均速率為υ(CO)=0.6 mol·L-1·min-1
B.4 min后,平衡移動的原因可能是向容器中加入了2.0 mol的SO2
C.若升高溫度,反應的平衡常數變為1.0,則正反應為吸熱反應
D.在此條件,若起始時容器中MgSO4、CO均為1.0 mol,則平衡時n(SO2)=0.6 mol
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三下學期考前練習化學試卷(解析版) 題型:選擇題
下列實驗操作、現象與結論對應關系正確的是
選項 | 操作 | 現象 | 結論 |
A | 將Fe(NO3)2溶于稀H2SO4后,滴加KSCN溶液 | 溶液變成紅色 | Fe(NO3)2中一定含Fe3+ |
B | 從煤油中取出一小塊鈉,用濾紙擦凈表面的煤油,放入無水乙醇中 | 產生氣泡 | Na能置換出醇羥基中的氫 |
C | 將某氣體通入品紅溶液 | 溶液褪色 | 氣體一定是SO2 |
D | 向NaAlO2溶液中滴入NaHCO3溶液 | 產生白色沉淀 | AlO2-結合H+的能力比CO3-強 |
查看答案和解析>>
科目:高中化學 來源:2016屆江蘇省高三下學期考前練習化學試卷(解析版) 題型:選擇題
常溫下,下列各組離子在指定溶液中一定能大量共存的是
A.使酚酞呈紅色的溶液:Na+、NO3-、Ba2+、Br-
B.加水稀釋pH減小的溶液:K+、Al3+、Cl-、CH3COO-
C.含有大量Fe(NO3)2的溶液:NH4+、H+、SO42-、I-
D.c(OH-)<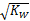 的溶液:ClO-、NO3-、Na+、Ca2+
的溶液:ClO-、NO3-、Na+、Ca2+
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏銀川二中高三三模理綜化學試卷(解析版) 題型:實驗題
工業廢鐵屑(含有一些不溶于酸的雜質)為原料生產硫酸鉀、過二硫酸銨和氧化鐵紅顏料,其主要流程如下:
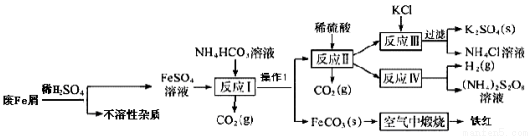
(1)反應I加入NH4HCO3的作用是除去過量的酸,還有一個作用是____________;
(2)反應I需控制反應溫度低于35℃,其目的是____________,操作①名稱是____________,檢驗反應Ⅱ溶液中陽離子的方法是____________;
(3)工業生產上常在反應Ⅲ的過程中加入一定量的醇類溶劑,其目的是____________;
(4)己知FeCO3的Ksp=2×10-11,反應I中Fe2+完全沉淀后,溶液中c(CO32-)=____________;
(5)寫出FeCO3在空氣中鍛燒的化學反應方程式____________;
(6) NH4C1溶液顯酸性,其濃溶液可用于除去鐵銹,其原理是(用離子反應方程式表示)____________。
查看答案和解析>>
科目:高中化學 來源:2016屆寧夏銀川二中高三三模理綜化學試卷(解析版) 題型:選擇題
下列離子方程式的書寫正確的是
A.誤將潔廁靈與消毒液混合:2H++Cl-+ClO-═Cl2↑+H2O
B.玻璃試劑瓶被燒堿溶液腐蝕:SiO2+2Na++2OH-═Na2SiO3↓+H2O
C.硝酸鋁溶液中加入過量氨水:Al3++4NH3•H2O=AlO2-+4NH4++2H2O
D.向NaHCO3溶液中加入過量的澄清石灰水,出現白色沉淀:Ca2++2OH-+2HCO3-=CaCO3↓+2H2O+CO32-
查看答案和解析>>
科目:高中化學 來源:2015-2016學年四川成都石室中學高二4月月考化學試卷(解析版) 題型:選擇題
常溫下,用0.1 mol·L-1NaOH溶液滴定0.1 mol·L-1 HA溶液,滴定曲線如下,下列分析錯誤的是
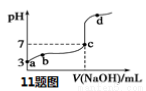
A.由a點推知HA是弱酸
B.a、b 點的溶液中,水的電離程度:a < b
C.c 點的溶液中: c(Na+)= c(A-) + c(HA)
D.d 點的溶液中: c(Na+) > c(A-)
查看答案和解析>>
科目:高中化學 來源:2016屆遼寧省高三第七次模擬理綜化學試卷(解析版) 題型:實驗題
Ⅰ.Fe3+具有氧化性,實驗室測定含碘廢液中I-的含量的過程如下:量取25.00 mL廢液于250 mL錐形瓶中,分別加入5 mL 2 mol·L-1 H2SO4和10 mL 20% Fe2(SO4)3溶液,搖勻。小火加熱蒸發至碘完全升華,取下錐形瓶冷卻后,加入幾滴二苯胺磺酸鈉(用作指示劑),用0.02500 mol·L-1標準K2Cr2O7溶液進行滴定到終點。重復3次,數據記錄如下表:
次數 | 1 | 2 | 3 |
滴定體積/mL | 19.98 | 20.02 | 19.00 |
(1)在盛有廢液的錐形瓶中先加入5 mL 2 mol·L-1 H2SO4的目的是
______________________________。(用離子方程式和語言敘述解釋)
(2)上述過程中涉及的反應:①2Fe3++2I-===2Fe2++I2 ②______________________________。
(3)根據滴定有關數據,該廢液中I-含量是_____g·L-1。
(4)在滴定過程中,下列操作(其他操作正確)會造成測定結果偏低的是___________。
A.終點讀數時俯視讀數,滴定前平視讀數
B.錐形瓶水洗衣后未干燥
C.滴定管未用標準K2Cr2O7溶液潤洗
D.盛標準K2Cr2O7溶液的滴定管,滴定前有氣泡,滴定后無氣泡
Ⅱ.Fe3+和Ag+的氧化性相對強弱一直是實驗探究的熱點。某學習小組同學設計如下實驗:
實驗編號 | 實驗操作 | 現象 |
1 | 向10mL 3mol/L KNO3酸性溶液(pH=1)中插入一根潔凈的Ag絲,并滴加NaCl溶液 | 無白色沉淀生成 |
2 | 向10mL 1mol/L AgNO3溶液中滴加2mL 0.1mol/L FeSO4溶液,振蕩,再滴加酸性KMnO4溶液 | 紫紅色不褪去 |
3 | 向10mL 1mol/L Fe(NO3)3酸性溶液(pH=1)中插入一根潔凈的Ag絲,并滴加NaCl溶液 | 有白色沉淀生成 |
請回答:
(5)設計實驗①的目的是______________________________。
(6)實驗③可得出結論是______________________________。
(7)寫出實驗②中反應的離子方程式______________________________。
(8)根據以上實驗,Fe3+和Ag+的氧化性相對強弱與離子____________________有關。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com