
(1)已知:N2(g)+O2(g)=2NO(g); △H=+180.5 kJ·mol-1
4NH3(g)+5O2(g)=4NO(g)+6H2O(g);△H=-905 kJ·mol-1
2H2(g)十O2(g)=2H2O(g):△H=--483.6 kJ·mol-1
則N2(g)+3H2(g) ![]() 2NH3(g)的△H= 。
2NH3(g)的△H= 。
(2)在一定條件下,將2mol N2與5mol H2混合于一個10 L的密閉容器中,反應情況如圖1所示:
①求5min內的平均反應速率v(NH3) ;
②達到平衡時NH3的體積分數為 。

圖1 圖2 電解法合成氨裝置
(3)近年來科學家采用高質子導電性的SCY陶瓷(能傳遞H+)為介質,用吸附在它內外表面上的金屬鈀多品薄膜做電極,實現了高轉化率的電解法合成氨(裝置如圖2)。鈀電極A上發生的電極反應式是 。
 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:
(11分)在汽車上安裝三效催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ·mol-1
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1
①尾氣轉化的反應之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
②已知:N2、O2分子中化學鍵的鍵能分別是946 kJ·mol—1、497 kJ·mol—1,則NO分子中化學鍵的鍵能為 kJ·mol—1。
(2)某研究性學習小組在技術人員的指導下,在某溫度時,按下列流程探究某種催化劑作用下的反應速率,用氣體傳感器測得不同時間的NO和CO濃度如表:
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):
①前3s內的平均反應速率v (N2) =_________________________。
②在該溫度下,反應的平衡常數K = 。(只寫出計算結果)
③該可逆反應△S 0(填“>”、“<”或“=”),在_______________(填“高溫”、“低溫”或“任何溫度”)下能自發進行。
(3)CO分析儀以燃料電池為工作原理,其裝置如圖所示,該電池中電解質為氧化釔-氧化鈉,其中O2-可以在固體介質NASICON中自由移動。下列說法錯誤的是
A.負極的電極反應式為:
CO+O2—―2e-=CO2
B.工作時電極b作正極,O2-由電極a流向電極b
C.工作時電子由電極a通過傳感器流向電極b
D.傳感器中通過的電流越大,尾氣中CO的含量越高
查看答案和解析>>
科目:高中化學 來源:2012屆浙江省寧波四中高三第一學期期末考試化學試卷 題型:填空題
(11分)在汽車上安裝三效催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
(1)已知:N2(g)+ O2(g)="2NO(g)" △H="+180.5" kJ·mol-1
2C(s)+ O2(g)="2CO(g) " △H=-221.0 kJ·mol-1
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1
①尾氣轉化的反應之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
②已知:N2、O2分子中化學鍵的鍵能分別是946 kJ·mol—1、497 kJ·mol—1,則NO分子中化學鍵的鍵能為 kJ·mol—1。
(2)某研究性學習小組在技術人員的指導下,在某溫度時,按下列流程探究某種催化劑作用下的反應速率,用氣體傳感器測得不同時間的NO和CO濃度如表: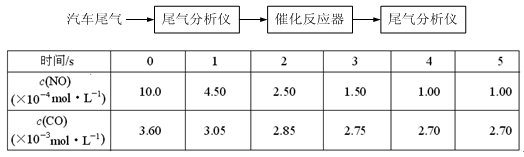
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):
①前3s內的平均反應速率v (N2) = _________________________。
②在該溫度下,反應的平衡常數K = 。(只寫出計算結果)
③該可逆反應△S 0(填“>”、“<”或“=”),在_______________(填“高溫”、“低溫”或“任何溫度”)下能自發進行。
(3)CO分析儀以燃料電池為工作原理,其裝置如圖所示,該電池中電解質為氧化釔-氧化鈉,其中O2-可以在固體介質NASICON中自由移動。下列說法錯誤的是 
| A.負極的電極反應式為: CO+O2—―2e-=CO2 |
| B.工作時電極b作正極,O2-由電極a流向電極b |
| C.工作時電子由電極a通過傳感器流向電極b |
| D.傳感器中通過的電流越大,尾氣中CO的含量越高 |
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省高三第一學期期末考試化學試卷 題型:填空題
(11分)在汽車上安裝三效催化轉化器,可使汽車尾氣中的主要污染物(CO、NOx、碳氫化合物)進行相互反應,生成無毒物質,減少汽車尾氣污染。
(1)已知:N2(g)+ O2(g)=2NO(g) △H=+180.5 kJ·mol-1
2C(s)+ O2(g)=2CO(g) △H=-221.0 kJ·mol-1
C(s)+ O2(g)=CO2(g) △H=-393.5 kJ·mol-1
①尾氣轉化的反應之一:2NO(g)+2CO(g)=N2(g)+2CO2(g) △H= 。
②已知:N2、O2分子中化學鍵的鍵能分別是946 kJ·mol—1、497 kJ·mol—1,則NO分子中化學鍵的鍵能為 kJ·mol—1。
(2)某研究性學習小組在技術人員的指導下,在某溫度時,按下列流程探究某種催化劑作用下的反應速率,用氣體傳感器測得不同時間的NO和CO濃度如表:
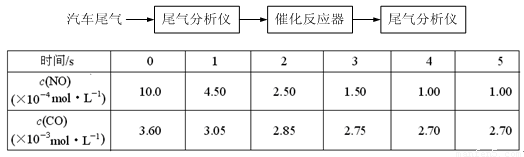
請回答下列問題(均不考慮溫度變化對催化劑催化效率的影響):
①前3s內的平均反應速率v (N2) = _________________________。
②在該溫度下,反應的平衡常數K = 。(只寫出計算結果)
③該可逆反應△S 0(填“>”、“<”或“=”),在_______________(填“高溫”、“低溫”或“任何溫度”)下能自發進行。
(3)CO分析儀以燃料電池為工作原理,其裝置如圖所示,該電池中電解質為氧化釔-氧化鈉,其中O2-可以在固體介質NASICON中自由移動。下列說法錯誤的是
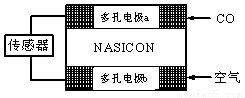
A.負極的電極反應式為:
CO+O2—―2e-=CO2
B.工作時電極b作正極,O2-由電極a流向電極b
C.工作時電子由電極a通過傳感器流向電極b
D.傳感器中通過的電流越大,尾氣中CO的含量越高
查看答案和解析>>
科目:高中化學 來源:2010-2011學年江蘇省常州市高三上學期期中考試化學 題型:填空題
(10分)以硫酸工業的尾氣、氨水、石灰石、焦炭及碳酸氫銨和KCl為原料可以合成有重要應用價值的硫化鈣、硫酸鉀、亞硫酸氫銨等物質。合成路線如下:

(1)已知對苯二酚是一種強還原劑。生產中,反應Ⅱ中往往需要向溶液中加入適量的對苯二酚等物質,其目的是 ▲ 。
(2)下列有關說法正確的是 ▲ 。
A.反應Ⅰ中需鼓入足量空氣,以保證二氧化硫充分氧化生成硫酸鈣
B.反應Ⅲ中發生反應的化學方程式為:CaSO4+4C CaS
+4CO↑
CaS
+4CO↑
C.反應Ⅳ需控制在60~70℃,目的之一是減少碳酸氫銨的分解
D.反應Ⅴ中的副產物氯化銨可用作氮肥
(3)反應Ⅴ反應液用40%乙二醇溶液,溫度控制在25℃,硫酸鉀的產率超過90%,其原因是 ▲ 。
(4)(NH4)2SO3可用于電廠等煙道氣中脫氮,將氮氧化物轉化為N2,試寫出二氧化氮與亞硫酸銨反應的化學方程式 ▲ 。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com