
【題目】下列物質不屬于氧化物的是 ( )
A.MgO B.HClO C.Cu2O D.ClO2
 口算心算速算應用題系列答案
口算心算速算應用題系列答案 同步拓展閱讀系列答案
同步拓展閱讀系列答案科目:高中化學 來源: 題型:
【題目】石棉尾礦主要含有Mg3(Si2O5)(OH)4和少量的Fe2O3、Al2O3。以石棉尾礦為供源制備碳酸鎂晶須(MgCO3·nH2O)的工藝如下:

已知“焙燒”過程中的主反應為:
Mg3(Si2O5)(OH)4+5(NH4)2SO4![]() 3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
3MgSO4+10NH3↑+2SiO2+7H2O↑+2SO3↑
(1)寫出焙燒產物NH3的電子式__________。
(2)為提高水浸速率,可采取的措施為_________(任寫一條)。“浸渣”的主要成分為________。
(3)“除鐵、鋁”時,需將pH調至8.0左右,適宜作調節劑的是_________(填字母代號)。
a. NaOH b.Ca(OH)2 c.NH3·H2O
(4)“沉鎂”過程中反應的離子方程式為________________。
(5)流程中可以循環利用的物質是________(填化學式)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】電化學在日常生活中用途廣泛,圖甲是鎂一次氯酸鈉熱料電池,電池總反應為:Mg+ClO-+H2O=Cl-+Mg(OH)2↓,圖乙是含Cr2O72-的工業廢水的處理。下列說法正確的是

A. 圖甲中發生的氧化反應是Mg2++ClO-+H2O+2e-=Cl-+Mg(OH)2
B. 圖乙中惰性電極棒上有02放出
C. 圖乙中Cr2O72-向惰性電極移動,與該極近的OH-結合轉化成Cr(OH)3除去
D. 若圖甲中3.6g鎂產生的電量用于圖乙廢水處理,理論上圖乙中有8.4g陽極材料參與反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】硒(Se)是一種有抗癌、抗氧化作用的元素,可以形成多種化合物。
(1)基態硒原子的價層電子排布式為____________。
(2)鍺、砷、硒的第一電離能大小排序為____________。H2SeO4的酸性比H2SeO3的強,其原因是__________。
(3)H2SeO3的中心原子雜化類型是_______;SeO32-的立體構型________。
(4)H2Se屬于____________ (填“極性”或“非極性”)分子;單質Se的熔點為217℃,它屬于_________晶體。
(5)硒化鋅是一種重要的半導體材料,其晶胞結構如圖所示,該晶胞中硒原子的配位數為_________;若該晶胞密度為ρg·cm-3,硒化鋅的摩爾質量為Mg/mol。NA代表阿伏加德羅常數,則晶胞參數a為__________pm。
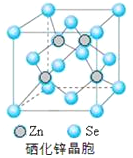
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】從宏觀現象探究微觀本質是重要的化學學科素養。以FeCl3溶液為實驗研究對象,探究其與堿性物質之間的復雜多樣性。實驗如下:
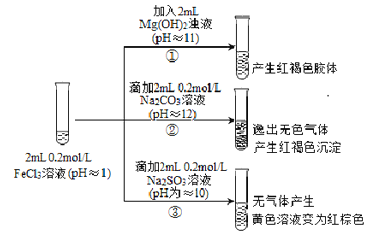
(1)①中反應的離子方程式是_________________。
(2)②中逸出的無色氣體是_______________。
(3)對于③中的實驗現象,同學們有諸多猜測,繼續進行實驗:
Ⅰ.甲取③中的紅棕色溶液少許,滴入少量鹽酸酸化的BaCl2溶液,產生白色沉淀。 甲得出結論:FeCl3與Na2SO3發生了氧化還原反應,離子方程式是______________。
Ⅱ.乙認為甲的實驗不嚴謹,重新設計并進行實驗,證實了甲的結論是正確的。其實驗方案是取Ⅰ中所得溶液少許進行__________離子的檢驗。
(4)受以上實驗的啟發,同學們對pH≈8的1mol/LNaF溶液與FeCl3溶液混合時的現象產生了好奇并進行實驗:
實驗操作及現象 | ④向2mL0.2mol/L FeCl3溶液中滴入2mL1mol/LNaF溶液。溶液變無色 |
⑤向2mL0.2mol/L FeCl3溶液中滴入2mL蒸餾水,溶液顏色變淺 |
Ⅰ.⑤的實驗目的是___________。
Ⅱ.為探究④中溶液變無色的原因,進行如下實驗:
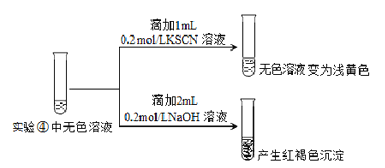
資料顯示:FeF3溶液為無色。
用平衡移動原理解釋紅褐色沉淀產生的原因:_______________。
(5)根據實驗,FeCl3溶液與堿性物質之間的反應的多樣性與_____________________有關。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某小組為研究電化學原理,設計如圖裝置。下列敘述不正確的是
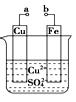
A. a和b不連接時,鐵片上會有金屬銅析出
B. a和b用導線連接時,銅片上發生的反應為:Cu2++2e-==Cu
C. 無論a和b是否連接,鐵片均會溶解,溶液均從藍色逐漸變成淺綠色
D. a和b分別連接直流電源正、負極,電壓足夠大時,Cu2+向銅電極移動
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在一密閉容器中進行反應:N2(g)+3H2(g) ![]() 2NH3(g)。反應從正反應開始。下列說法錯誤的是
2NH3(g)。反應從正反應開始。下列說法錯誤的是
A. 反應開始時,正反應速率最大 B. 反應開始時,v逆(NH3)=0
C. v(H2)∶v(NH3)=3∶2時,反應達到平衡狀態 D. 單位時間內,消耗n mol N2的同時生成3n mol H2 ,此時該反應達到平衡狀態
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】科學家及其提出學說與貢獻的敘述不對應的是( )
A. 道爾頓提出原子學說
B. 湯姆生發現電子,并提出原子結構軌道模型
C. 舍勒發現了氯氣
D. 盧瑟福根據α粒子散射現象,提出了帶核的原子結構模型
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】物質氧化性、還原性的強弱,不僅與物質的結構有關,還與物質的濃度和反應溫度有關。下列各組物質:①Cu與HNO3溶液 ②Cu與FeCl3溶液 ③Zn與H2SO4溶液 ④Fe與HCl溶液,由于溶液濃度不同而能發生不同氧化還原反應的是
A. ①③ B. ③④ C. ①② D. ①④
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com