
| 陽離子 | Na+、Ba2+、NH4+ |
| 陰離子 | CH3COO-、OH-、Cl-、SO42- |
分析 ①A、C溶液的pH均大于7,應為醋酸鹽和堿溶液,A、B的溶液中水的電離程度相同,則溶液水解程度相同;
②C溶液和D溶液相遇時只生成白色沉淀,B溶液和C溶液相遇時只生成刺激性氣味的氣體,A溶液和D溶液混合時無明顯現象,則說明C為Ba(OH)2,D為Na2SO4,則B為NH4Cl,A為CH3COONa,以此解答該題.
解答 解:①A、C溶液的pH均大于7,應為醋酸鹽和堿溶液,A、B的溶液中水的電離程度相同,則溶液水解程度相同;
②C溶液和D溶液相遇時只生成白色沉淀,B溶液和C溶液相遇時只生成刺激性氣味的氣體,A溶液和D溶液混合時無明顯現象,則說明C為Ba(OH)2,D為Na2SO4,則B為NH4Cl,A為CH3COONa,
(1)根據題中信息推斷出各物質分別為:A為CH3COONa,B為NH4Cl,C為Ba(OH)2,D為Na2SO4,
故答案為:CH3COONa;NH4Cl;
(2)醋酸鈉水解呈堿性,離子方程式為CH3COO-+H2O?CH3COOH+OH-,故答案為:CH3COO-+H2O?CH3COOH+OH-;
(3)C為Ba(OH)2,D為Na2SO4,C和D反應的離子方程式為:Ba2++SO42-═BaSO4↓,故答案為:Ba2++SO42-═BaSO4↓;
(4)在氯化銨中,存在電荷守恒:c(OH-)+c(Cl-)=c(NH4+)+c(H+),存在原子守恒:c(Cl-)=c(NH4+)+ c(NH3•H2O),根據兩個等式可以得出c(H+)-c(NH3•H2O)=c(OH-)=1×10(a-14)
故答案為:10a-14mol•L-1;
(5)等體積、等物質的量濃度的NH4Cl和Ba(OH)2混合反應后溶液中溶質是BaCl2、Ba(OH)2、NH3•H2O,則c(OH-)>c(Ba2+)=c(Cl-)>c(NH4+)>c(H+),
故答案為:c(OH-)> c(Ba2+)= c(Cl-)> c(NH4+)> c(H+).
點評 本題較為綜合,涉及無機物的推斷、電解質在水溶液中的電離、pH的簡單計算、鹽類水解的應用等知識,難度較大,正確推斷各種物質為解答本題的關鍵.


 華東師大版一課一練系列答案
華東師大版一課一練系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 用苯萃取溴水中的溴時,將溴的苯溶液從分液漏斗下口倒出 | |
| B. | 使用容量瓶的第一步操作是先將容量瓶用蒸餾水洗滌后烘干 | |
| C. | 檢驗某溶液是否含有SO42-時,應取少量該溶液,依次加入BaCl2溶液和稀鹽酸 | |
| D. | 用10mL量筒量取9.2mL NaCl溶液 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 22.4LCO2與足量的 Na2O2反應時,轉移的電子數為 NA 個 | |
| B. | 0.1mol 鐵在 0.1molCl2 中充分燃燒,轉移的電子數為 0.2NA 個 | |
| C. | 對于反應:A(g)+B(g)?C(g)+D(g)單位時間內生成 NA 個 A 分子時,同時消耗NA 個 C 分子,說明該反應一定達到最大限度 | |
| D. | Zn-H2SO4-Cu 原電池中,當電路中有 NA 個電子通過時,溶液的質量增加 1g |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
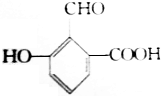 具有的三種官能團分別是:羥基、醛基和羧基,所以這種化合物可看作酚類、醛類和羧酸類.
具有的三種官能團分別是:羥基、醛基和羧基,所以這種化合物可看作酚類、醛類和羧酸類.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 氣體通過無水硫酸銅,粉末變藍,證明原氣體中含有水蒸氣 | |
| B. | 碳酸鈉可作為治療胃酸過多的藥物,食品發酵劑 | |
| C. | 通過丁達爾效應可以鑒別稀豆漿和氫氧化鐵膠體 | |
| D. | 焰色反應一定伴隨著化學變化和物理過程 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 ;與甲分子具有相同電子數且含元素種類相同的離子有(填化學式):OH-、H3O+.
;與甲分子具有相同電子數且含元素種類相同的離子有(填化學式):OH-、H3O+. Fe(OH)3+3H+△H>0,平衡正向移動,當水解出的Fe(OH)3較多時就聚集為沉淀.
Fe(OH)3+3H+△H>0,平衡正向移動,當水解出的Fe(OH)3較多時就聚集為沉淀.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
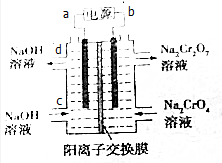 已知反應:2CrO42-+2H+?Cr2O72-+H2O.某科研小組用如圖電解裝置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有關敘述正確的是( )
已知反應:2CrO42-+2H+?Cr2O72-+H2O.某科研小組用如圖電解裝置,由Na2CrO4溶液制取Na2Cr2O7溶液.下列有關敘述正確的是( )| A. | CrO42-生成Cr2O72-的反應為非氧化還原反應,不能通過電解方法獲得 | |
| B. | a為電源正極 | |
| C. | d口流出的NaOH溶液的濃度與c口通入的NaOH溶液的濃度相同 | |
| D. | Na+從右側通過陽離子交換膜進入左側 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com