
【題目】下列說法中,正確的是( )
A.丙烯的結構簡式為 CH3CHCH2
B.結構為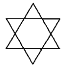 的有機物的分子式為 C12H12
的有機物的分子式為 C12H12
C.分子式為 C4H9Cl 的同分異構體共有 5 種
D.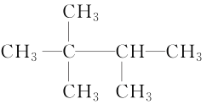 與(CH3)3CCH(CH3)2 不是同一物質
與(CH3)3CCH(CH3)2 不是同一物質
科目:高中化學 來源: 題型:
【題目】K2Cr2O7溶液中存在平衡:Cr2O72-(橙色)+H2O2CrO42-(黃色)+2H+。用K2Cr2O7溶液進行下列實驗:
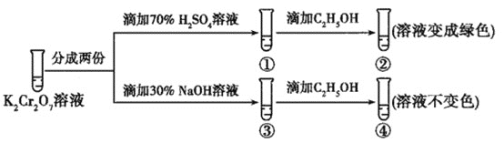
結合實驗,下列說法不正確的是( )
A.①中溶液橙色加深,③中溶液變黃
B.②中Cr2O72-被C2H5OH還原
C.對比②和④可知K2Cr2O7酸性溶液氧化性強
D.若向④中加入70%H2SO4溶液至過量,溶液變為橙色
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】為了研究有機物A的組成與結構,某同學進行如下實驗。
i.將9.0gA 在足量氧氣中充分燃燒,并使其產物依次緩緩通過足量的濃硫酸和堿石灰,發現兩者分別增重5.4g和13.2g。
ii.通過質譜法測得其相對分子質量為90。
ili.通過紅外光譜法測得A中含有—OH和—COOH。
請回答下列問題。
(1)9.0gA完全燃燒生成水的物質的量是____________mol。
(2)A的實驗式是____________。
(3)A的分子式是____________。
(4)在一定條件下,若兩個A分子可以反應得到一個六元環的分子,則A的結構簡式是____________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二甲醚(CH3OCH3)是一種清潔能源。工業上,常利用CO2和H2合成二甲醚。有關反應如下(z、y、z均大于0):
①2CH3OH(g)CH3OCH3(g)+H2O(g) △H1= -xkJ·mol-1
②CO(g)+H2O(g)CO2(g)+H2(g) △H2= -ykJ·mol-1
③CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H3= -zkJ·mol-1
(1)2CO2(g)+6H2(g)CH3OCH3(g)+3H2O(g) △H= ___________kJ·mol-1
(2)下列有關合成二甲醚的說法正確的是 ___(填字母)。
a.增大壓強能提高反應速率和CO2的平衡轉化率
b.體系中減小![]() ,平衡一定向正方向移動
,平衡一定向正方向移動
c.容器體積一定,混合氣體密度不變時一定達到平衡狀態
d.充入適量CO,可能提高CH3OCH3的產率
(3)在一定溫度下,在恒容密閉容器中發生反應:CO(g)+H2O(g)CO2(g)+H2(g),速率表達式為v=v正-v逆=k正c(CO)·c(H2O)-k逆c(CO2)·c(H2O)(其中,k正、k逆為正、逆速率常數,與濃度無關)。達到平衡時,升高溫度,![]() 將_____選填“增大”“減小”或“不變”)。
將_____選填“增大”“減小”或“不變”)。
(4)在恒容密閉容器中用CO2和H2合成二甲醚時CO2的平衡轉化率與溫度、投料比 的關系如圖所示。
的關系如圖所示。
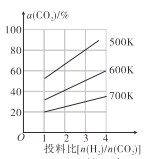
①500K時,將9mol H2和3mol CO2充入2L恒容密閉容器中,5min時反應達到平衡狀態,則0~5min內的平均反應速率v(H2)=____________ molL-1min-l,該溫度下,反應的平衡常數K=____(列出計算式即可,無需化簡)。
②由圖像可以得出的結論是_________(答兩條)。
(5)工業上也可用CO和H2合成二甲醚,而且二者還能作燃料電池的燃料。以CO、H2體積比為1:2的混合氣體與空氣在KOH溶液中構成燃料電池(以石墨為電極),開始時,負極的電極反應式為____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是( )
A.NH3 是極性分子,分子中 N 原子處在 3 個 H 原子所組成的三角形的中心
B.氨氣易溶于水的原因之一是氨氣分子與水分子之間能形成氫鍵
C.乙醇分子與水分子之間只存在范德華力
D.氯的各種含氧酸的酸性由強到弱的排列順序為HClO>HClO2>HClO3>HClO4
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】
GaN是制造5G芯片的材料,氮化鎵和氮化鋁LED可發出紫外光。回答下列問題:
(1)基態Ga原子的核外電子排布式為[Ar]____。
(2)根據元素周期律,元素的電負性Ga____ (填“大于”或“小于”,下同)As。
(3)科學家合成了一種陽離子為“N5n+”,其結構是對稱的,5個N排成“V”形,每個N原子都達到8電子穩定結構,且含有2個氮氮三鍵;此后又合成了一種含有“N5n+”化學式為“N8”的離子晶體,其電子式為____,其中的陰離子的空間構型為____。
(4)組成相似的CaF3和GaCl3晶體,前者屬于離子晶體,后者屬于分子晶體。從F-和Cl-結構的不同分析其原因是________。
(5)原子晶體GaAs的晶胞參數a=xpm,它的晶胞結構如下圖所示。該晶胞內部存在的共價鍵數為 ___;緊鄰的As原子之間的距離為b,緊鄰的As、Ca原子之間的距離為d,則b:d=____,該晶胞的密度為__g cm-3。(阿伏加德羅常數用NA表示)
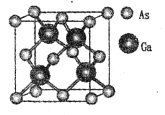
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法錯誤的是( )
A.12g石墨中含有σ鍵的物質的量為1.5mol
B.硫離子電子共有18種運動狀態,且其2p與3p軌道形狀和能量相等
C.電負性:C<N<O
D.I3+離子的幾何構型是V型
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】甲烷水蒸氣的重整反應是工業制備氫氣的重要方式,其化學反應方程式為CH4(g)+H2O(g)![]() CO(g)+3H2(g)。回答下列問題:
CO(g)+3H2(g)。回答下列問題:
(1)已知CH4(g)+2O2(g)=CO2(g)+2H2O(l) ΔH1=-890.3kJ·mol-1
CO(g)+0.5O2(g)=CO2(g) ΔH2=-283.0kJ·mol-1
H2(g)+0.5O2(g)=H2O(l) ΔH3=-285.8kJ·mol-1
CO(g)+H2O(g)=CO2(g)+H2(g) ΔH4=-41.0kJ·mol-1
則甲烷水蒸氣重整反應的ΔH=_____kJ·mol-1。
(2)通過計算機模擬實驗,對400~1200℃、操作壓強為0.1MPa條件下,不同水碳比(1~10)進行了熱力學計算,反應平衡體系中H2的物質的量分數與水碳比、平衡溫度的關系如圖所示。
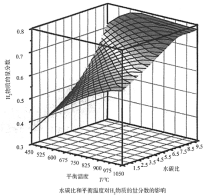
①溫度一定時,H2的物質的量分數與水碳比(1~10)的關系是_____,產生該結論的原因是_____。
②據模擬實驗可知,平衡溫度為900℃,水碳比為1.0時,H2的物質的量分數為0.6,CH4的轉化率為_____,其壓強平衡常數為_____;反應速率方程為v=kp(CH4)p-1(H2),此時反應速率v=_____。
(已知:氣體分壓=氣體的物質的量分數×總壓,速率方程中k為速率常數)。
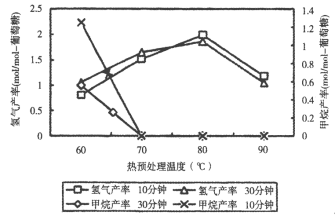
(3)厭氧細菌可將葡萄糖轉化為CH4和H2,pH為5.5時不同熱預處理溫度和時間下的甲烷和氫氣的產率如圖所示,若要提高H2的產率,最佳溫度為_____。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氨甲環酸(G),別名止血環酸,是一種已被廣泛使用半個世紀的止血藥,它的一種合成路線如下(部分反應條件和試劑略)。
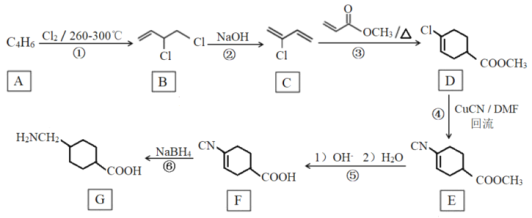
(1)A的名稱是_________________。
(2)②的化學方程式是___________。
(3)③的反應類型是_____________。
(4)D中的官能團名稱是_________。
(5)下列說法正確的是_____________(填字母序號)。
a.反應⑥是還原反應
b.F與![]() 互為同分異構體
互為同分異構體
c.G在堿性條件下可以轉變成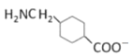
d.G在酸性條件下可以轉變成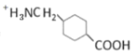
(6)寫出滿足以下條件的所有E的同分異構體的結構簡式______________________。
a. 與硝基苯互為同系物 b.苯環上只有兩個取代基 c.苯環上一氯代物有2種
(7)以CH3CH=CH2、HCHO為有機原料,選用必要的無機試劑合成上述流程中的A:CH3-CH=CH2![]() Br-CH2-CH=CH2→___________。已知:RX
Br-CH2-CH=CH2→___________。已知:RX![]() R—MgX
R—MgX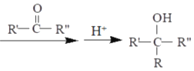 (R、R'、R〃代表烴基或氫)
(R、R'、R〃代表烴基或氫)
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com