13.0g鋅與足量的稀鹽酸完全反應,最多可收集到多少體積(標準狀況下)的氫氣?
【答案】
分析:13g鋅的物質的量為0.2mol,鋅與鹽酸發生反應Zn+2HCl=ZnCl
2+H
2↑,根據方程式計算生成的氫氣的物質的量,再根據V=nVm計算氫氣體積.
解答:解:13g鋅的物質的量為
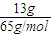
=0.2mol,令生成的氫氣的物質的量為n,則:
Zn+2HCl=ZnCl
2+H
2↑
1 1
0.2mol n
所以n=0.2mol
故標準狀況下生成氫氣的體積為0.2mol×22.4L/mol=4.48L.
答:標準狀況下最多可收集氫氣4.48L.
點評:考查學生根據方程式的計算,比較基礎,旨在考查學生對基礎知識的掌握,掌握根據方程式計算的方法.

 每課必練系列答案
每課必練系列答案