
【題目】利用鋁灰(主要成分為Al、Al2O3、AlN、FeO等)制備鋁鞣劑[主要成分為Al(OH)2Cl]的一種工藝如下: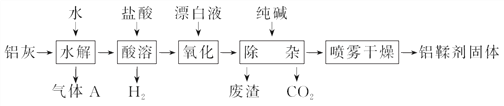
(1)氣體A能使濕潤的紅色石蕊試紙變藍。鋁灰在90 ℃水解生成A的化學方程式為_________________________________________。“水解”采用90 ℃而不在室溫下進行的原因是_________________________________________________;
(2)“酸溶”時,Al2O3發生反應的離子方程式為_____________________;
(3)“氧化”時,發生反應的離子方程式為________________________________;
(4)“廢渣”成分為________(填化學式);
(5)采用噴霧干燥而不用蒸發的原因是______________________________。
【答案】AlN+3H2O![]() Al(OH)3+NH3↑ 加快AlN水解反應速率;降低NH3在水中的溶解度,促使NH3逸出 Al2O3+6H+=2Al3++3H2O 2Fe2++2H++ClO-=2Fe3++Cl-+H2O Fe(OH)3 防止Al(OH)2Cl水解生成Al(OH)3
Al(OH)3+NH3↑ 加快AlN水解反應速率;降低NH3在水中的溶解度,促使NH3逸出 Al2O3+6H+=2Al3++3H2O 2Fe2++2H++ClO-=2Fe3++Cl-+H2O Fe(OH)3 防止Al(OH)2Cl水解生成Al(OH)3
【解析】
(1) 氣體A能使濕潤的紅色石蕊試紙變藍,說明A為NH3,則表示AlN發生了水解反應,控制溫度90 ℃而不在室溫下進行是因為NH3極易溶解于水,升溫可降低其溶解促進NH3逸出。故答案為:AlN+3H2O![]() Al(OH)3+NH3↑,加快AlN水解反應速率;降低NH3在水中的溶解度,促使NH3逸出。
Al(OH)3+NH3↑,加快AlN水解反應速率;降低NH3在水中的溶解度,促使NH3逸出。
(2)“酸溶”時,Al2O3和酸發生了復分解反應,要注意Al2O3不可以拆分。離子方程式為Al2O3+6H+=2Al3++3H2O。
(3)因為溶液中唯一易氧化的離子是Fe2+,故為用漂白液氧化溶液中的Fe2+,離子方程式書寫時要考慮溶液的酸性環境,結合電子守恒寫出反應的離子方程式為:2Fe2++2H++ClO-=2Fe3++Cl-+H2O。
(4)“除雜”目的就是除去溶液中的Fe3+,因此很明顯廢渣為Fe(OH)3。
(5)加熱蒸發會促進Al3+離子的水解,使Al3+離子最終水解為Al(OH)3。故答案為:防止Al(OH)2Cl水解生成Al(OH)3。


科目:高中化學 來源: 題型:
【題目】下列反應中,屬于加成反應的是( )
A. CH2===CH2+H2![]() CH3CH3B.
CH3CH3B. ![]()
C. CH3CH2OH+3O2![]() 2CO2+3H2OD. CH3COOH+CH3CH2OH
2CO2+3H2OD. CH3COOH+CH3CH2OH![]() CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向含amolNaClO的溶液通入bmolSO2充分反應(不考慮二氧化硫與水之間的反應以及次氯酸的分解)。下列說法不正確的是( )
A.當0<b<![]() 時:SO2+H2O+3ClO-=SO42-+2HClO+Cl-
時:SO2+H2O+3ClO-=SO42-+2HClO+Cl-
B.當b=a時:溶液的酸性明顯增強
C.![]() ≤b≤a時:反應后溶液中H+的物質的量:0<n(H+)≤2bmol
≤b≤a時:反應后溶液中H+的物質的量:0<n(H+)≤2bmol
D.當0<b<![]() :SO2+H2O+2ClO-=SO32-+2HClO
:SO2+H2O+2ClO-=SO32-+2HClO
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列說法正確的是
A. 按系統命名法,化合物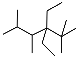 的名稱是2,3,5,5-四甲基-4,4-二乙基己烷
的名稱是2,3,5,5-四甲基-4,4-二乙基己烷
B. 等物質的量的苯與苯甲酸完全燃燒消耗氧氣的量不相等
C. 苯不能使酸性KMnO4溶液褪色,但苯的同系物均可以
D. 結構片段為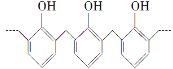 的高聚物,其單體是甲醛和苯酚
的高聚物,其單體是甲醛和苯酚
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的物質的量隨時間變化的曲線如圖所示,下列說法正確的是( )
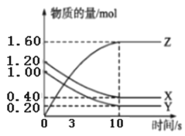
A.該反應的化學方程式為3X+Y![]() 2Z
2Z
B.3s時,正逆反應速率相等
C.平衡時X的濃度為0.40mol/L
D.10s時,該反應達到了最大限度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】完成下列問題
(1)硬脂酸甘油酯的結構簡式____________
(2)用系統命名法命名 ![]() 為___________________
為___________________
(3)酸催化條件下制備酚醛樹脂的化學方程式____________________________________________
(4)1,3-丁二烯與丙烯等物質的量發生加聚反應的化學方程式______________________________
(5)葡萄糖發生銀鏡反應的化學方程式_____________________________________
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】氰基丙烯酸酯在堿性條件下能快速聚合為![]() ,從而具有膠黏性。某種氰基丙烯酸酯(G)的合成路線如下:
,從而具有膠黏性。某種氰基丙烯酸酯(G)的合成路線如下:
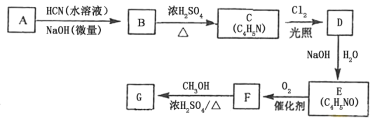
已知:①A的相對分子質量為58,氧元素質量分數為0.276,核磁共振氫譜顯示為單峰。
②![]()
回答下列問題:
(1)A的化學名稱為________________。
(2)B的結構簡式為_____________,其核磁共振氫譜顯示為_______組峰,峰面積比為_________。
(3)由C生成D的反應類型為__________。
(4)由D生成E的化學方程式為_________________________________________。
(5)G的同分異構體中,與G具有相同官能團且能發生銀鏡反應的共有____種。(不含立體異構)
(6)F與H2反應后生成C4H9NO2,此物質一定條件下發生聚合反應的化學方程式為___________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下表列出前20號元素中的某些元素性質的一些數據:
元素 | A | B | C | D | E | F | G | H | I | J |
原子半徑 (10-10m) | 1.02 | 2.27 | 0.74 | 1.43 | 0.77 | 1.10 | 0.99 | 1.86 | 0.75 | 1.17 |
最高價態 | +6 | +1 | — | +3 | +4 | +5 | +7 | +1 | +5 | +4 |
最低價態 | -2 | — | -2 | — | -4 | -3 | -1 | — | -3 | -4 |
試回答下列問題:
(1)以上10種元素中第一電離能最小的是____(填編號)。比元素B原子序數大10的元素在元素周期表中的位置:第____周期第____族,其基態原子的核外電子排布式是___________。
(2)由上述C、E、G三種元素中的某兩種元素形成的化合物中,每個原子的最外層都滿足8電子穩定結構的可能是____(寫分子式,寫出兩種即可),元素G、I分別和J形成的兩種化合物的晶體類型分別是_________、___________。
(3)元素E與C及氫元素可形成一種相對分子質量為60的一元羧酸分子。 其分子中共形成____個σ鍵,____個π鍵。
(4)短周期某主族元素K的電離能情況如圖(A)所示。則K元素位于周期表的第_____周期、第____族。
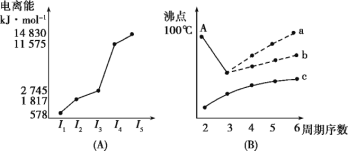
圖(B)是研究部分元素的氫化物的沸點變化規律的圖像,折線c可以表達出第____族元素氫化物的沸點的變化規律。不同同學對某主族元素的氫化物的沸點變化趨勢畫出了兩條折線——折線a和折線b,你認為正確的是____,理由是_______________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】在FeCl3和CuCl2的混合液中逐漸加入鐵粉,溶液中Fe2+的物質的量濃度和加入鐵粉的物質的量之間關系如圖所示。則該溶液中FeCl3與CuCl2的物質的量濃度之比為

A. 3∶1 B. 1∶2 C. 2∶1 D. 1∶1
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com