
【題目】在無色透明的溶液中,能夠大量共存的離子組是
A. Al3+、Ca2+、Cl-、NO3- B. Ba2+、K+、CO32-、Cl-
C. Na+、Cu2+、NO3-、HCO3- D. Na+、Fe2+、Cl-、SO42-
 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:
【題目】有如下合成路線,甲經二步轉化為丙,下列敘述不正確的是( ) 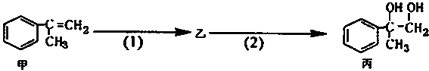
A.丙中可能含有未反應的甲,可用溴水檢驗是否含甲
B.反應(1)的無機試劑是液溴,鐵作催化劑
C.甲和丙均可與酸性KMnO4溶液發生反應
D.反應(2)反應屬于取代反應
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】類推思維是化學解題中常用的一種思維方法,下列有關離子方程式的類推正確的是( )
已知 | 類推 | |
A | 將Fe加入CuSO4溶液中:Fe+Cu2+=Cu+Fe2+ | 將Na加入到CuSO4溶液中:2Na+Cu2+=Cu+2Na+ |
B | 向Ca(ClO)2溶液中通入少量CO2 Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2:Ca2++2ClO-+SO2+H2O=CaSO3↓+2HClO |
C | 用惰性電極電解NaCl溶液:2Cl-+2H2O | 用惰性電極電解MgBr2溶液:2Br-+2H2O |
D | 稀鹽酸與NaOH溶液反應至中性:H++OH-=H2O | 稀HNO3與Ba(OH)2溶液反應至中性:H++OH-=H2O |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】將純水加熱至較高溫度,下列敘述正確的是( )
A.水的離子積變大、pH變小、呈酸性
B.水的離了積不變、pH不變、呈中性
C.水的離子積變小、pH變大、呈堿性
D.水的離子積變大、pH變小、呈中性
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】已知:甲、乙、丙為常見單質,甲常溫下為固體,乙為一黃綠色氣體,丙為無色氣體。A、B、C、D均為化合物,D為一紅褐色沉淀,它們之間有下圖轉化關系。
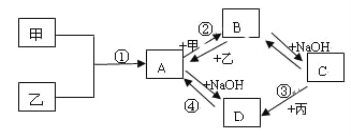
請回答以下問題。
(1)寫出下列物質的名稱;乙____________;B______________。
(2)寫出③反應的化學方程式:_____________________________。
(3)寫出②反應的離子方程式:____________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】二氯化砜(SO2Cl2)是一種重要的有機合成試劑,實驗室可利用SO2與Cl2反應制取少量的SO2Cl2。裝置如圖(有些支持裝置省略了)所示。
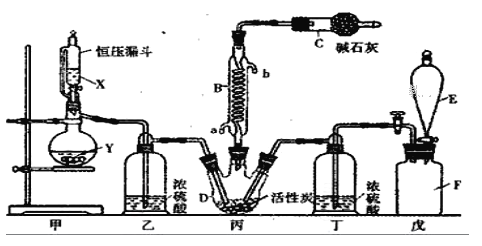
已知SO2Cl2的熔點為-54.1℃,沸點為69. 1℃;常溫下比較穩定,受熱易分解,遇水能發生劇烈的水解反應,產物之一為氯化氫氣體。
(1)戊是貯氣裝置, F瓶中的氣體能使濕潤的有色布條褪色,則F瓶中的氣體的實驗室制法是________________________________(用方程式表示);
(2)B處反應管冷卻水應從__________(填“a”或“b”)接口通入;C儀器的名稱為____________,堿石灰的作用為____________。
(3)裝置乙和丁的作用是____________;
(4)恒壓漏斗具有特殊的結構,主要目的是___________;
(5)寫出二氯化砜(SO2Cl2)水解反應的方程式________________;
(6)SO2溶于水生成亞硫酸,亞硫酸的酸性強于次氯酸,選用下面的裝置和藥品探究亞硫酸與次氯酸的酸性強弱:

裝置連接順序為A、_______、______、______、D、F,其中E的作用是____________,通過________________現象即可證明亞硫酸的酸性強于次氯酸。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】關于Na2CO3和NaHCO3性質的說法正確的是
A. 在水中的溶解性: NaHCO3>Na2CO3
B. 熱穩定性:NaHCO3<Na2CO3
C. 與酸反應的劇烈程度: NaHCO3<Na2CO3,
D. 只能讓NaHCO3轉化成Na2CO3
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】有機物A是一元羧酸,由C,H,O元素組成,質量分數:C%40%;H 6.67%;取0.60g A配成溶液,用含0.01mol NaOH 的溶液能恰好完全中和.
(1)A的最簡式為;最簡式量為 .
(2)A的相對分子質量為;分子式為 .
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com