
| A. | 飽和純堿(Na2CO3)溶液中:2c(Na+)=c(CO32-)+c(HCO3-)+c(H2CO3) | |
| B. | 1mol/L的(NH4)2SO4溶液中:c(NH4+)>c(SO42-)>c(H+)>c(OH-) | |
| C. | 0.10mol/L醋酸鈉溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| D. | 等體積,pH=3的鹽酸和醋酸中和氫氧化鈉的物質的量相同 |
分析 A.根據碳酸鈉溶液中的物料守恒判斷;
B.銨根離子部分水解,溶液顯示酸性,則c(H+)>c(OH-),由于銨根離子的水解程度減小,則c(NH4+)>c(SO42-);
C.根據醋酸鈉溶液中的電荷守恒分析;
D.醋酸為弱酸,等體積、等pH的兩溶液中,醋酸的物質的量大于鹽酸,則醋酸消耗的氫氧化鈉的物質的量多.
解答 解:A.飽和純堿(Na2CO3)溶液中,根據物料守恒可得:c(Na+)=2c(CO32-)+2c(HCO3-)+2c(H2CO3),故A錯誤;
B.1mol/L的(NH4)2SO4溶液中,NH4+部分水解,溶液顯示酸性,則:c(H+)>c(OH-),由于NH4+的水解程度減小,則c(NH4+)>c(SO42-),溶液中離子濃度大小為:c(NH4+)>c(SO42-)>c(H+)>c(OH-),故B正確;
C.0.10mol/L醋酸鈉溶液中,根據電荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故C正確;
D.等體積、pH=3的鹽酸和醋酸中,由于醋酸為弱電解質,在溶液中部分電離出氫離子,則醋酸的濃度大于鹽酸,兩溶液在醋酸的物質的量大于鹽酸,故中和氫氧化鈉的物質的量不相等,故D錯誤;
故選BC.
點評 本題考查了離子濃度大小比較,題目難度中等,明確電荷守恒、物料守恒及鹽的水解原理為解答關鍵,D為易錯點,注意弱電解質在溶液中存在電離平衡,試題充分考查了學生靈活應用基礎知識的能力.


 名校課堂系列答案
名校課堂系列答案科目:高中化學 來源: 題型:多選題
| A. | 溴化鋁(無色晶體,熔點98℃,熔融態不導電) | |
| B. | 碳化鋁(黃色晶體,熔點2200℃,熔融態不導電) | |
| C. | 氟化鋁(無色晶體,熔融時或溶于水時破壞了相同的作用力) | |
| D. | 五氟化釩(無色晶體,熔點19.5℃,易溶于乙醇) |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 生物酶固氮相比人工固氮更高效、條件更溫和 | |
| B. | 近日用地溝油煉制的生物航油載客首飛,標志著我國航空業在節能減排領域進入商業飛行階段 | |
| C. | 分光光度計不能用于測定草酸與高錳酸鉀的反應速率 | |
| D. | 尿液燃料電池的原理是在微生物作用下將尿液中的有機物轉化為電能 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| B | ||
| A | X | C |
| D |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 $→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$
$→_{③△}^{①OH-,②H_{3}O+}$D$\stackrel{SOCl_{2}}{→}$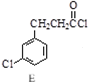 $\stackrel{AlCl_{3}}{→}$
$\stackrel{AlCl_{3}}{→}$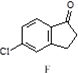
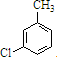 ,反應E→F的反應類型取代反應.
,反應E→F的反應類型取代反應.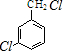 +3NaOH$→_{催化劑}^{高溫、高壓}$
+3NaOH$→_{催化劑}^{高溫、高壓}$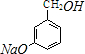 +2NaCl+H2O.
+2NaCl+H2O. (任寫一種).
(任寫一種). .
.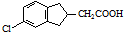 的合成路線流程圖(注明反應條件).合成路線流程圖示例如下:
的合成路線流程圖(注明反應條件).合成路線流程圖示例如下:
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
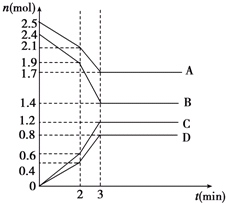 在某一容積為2L的恒容密閉容器中,A、B、C、D四種物質的物質的量n(mol)隨時間t(min)的變化曲線如圖所示.回答下列問題:
在某一容積為2L的恒容密閉容器中,A、B、C、D四種物質的物質的量n(mol)隨時間t(min)的變化曲線如圖所示.回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| 選項 | 規律(或性質) | 結 論 |
| A | 主族元素最高正化合價等于族序數 | 第VⅡA族元素最高正價都是+7 |
| B | SO2和濕潤的Cl2都有漂白性 | 二者混合后漂白性更強 |
| C | 常濕下銅與濃硝酸反應可以制取NO2 | 常溫下鐵與濃硝酸反應也可以制取NO2 |
| D | 較強酸可以制取較弱酸 | CO2通入NaClO溶液液中能生成HC10 |
| A. | A、 | B. | B、 | C. | C、 | D. | D、 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
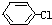 +NaOH→
+NaOH→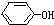 +NaCl,該反應的反應類型屬于( )
+NaCl,該反應的反應類型屬于( )| A. | 加成反應 | B. | 取代反應 | C. | 氧化還原反應 | D. | 置換反應 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
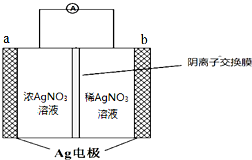 銀是一種在工業、生活上有廣泛用途的金屬.
銀是一種在工業、生活上有廣泛用途的金屬.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com