
| A. | N2的電子式: | |
| B. | 質子數為53、中子數為78的碘原子:${\;}_{53}^{131}$I | |
| C. | S2-的結構示意圖: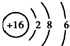 | |
| D. | O原子的基態電子排布式為:1s22s22p${\;}_{x}^{2}$p${\;}_{y}^{2}$p${\;}_{z}^{0}$. |
分析 A.氮氣分子中含有氮氮三鍵,N原子最外層達到8電子穩定結構,該電子式中漏掉了N原子的1對孤電子對;
B.質量數=質子數+中子數,元素符號左上角為質量數、左下角為質子數;
C.硫離子的核外電子總數為18,最外層達到8電子穩定結構;
D.2p軌道的4個電子的分步為2p$\stackrel{2}{x}$p$\stackrel{1}{y}$p$\stackrel{1}{z}$p.
解答 解:A.氮氣中氮原子之間通過三鍵均達到了8電子穩定結構,氮氣正確的電子式為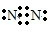 ,故A錯誤;
,故A錯誤;
B.質子數為53、中子數為78的碘原子的質量數為131,該原子可以表示為:${\;}_{53}^{131}$I,故B正確;
C.S2-的質子數為16,核外電子數為18,各層電子數分別為2、8、8,硫離子結構示意圖為 ,故C錯誤;
,故C錯誤;
D.O元素為8號元素,原子核外有8個電子,其核外電子正確的排布式為1s22s22 p$\stackrel{2}{x}$p$\stackrel{1}{y}$p$\stackrel{1}{z}$p,故D錯誤;
故選B.
點評 本題考查了常見化學用語的表示方法,題目難度中等,涉及電子式、離子結構示意圖、元素符號、核外電子排布式等知識,明確常見化學用語的書寫原則為解答關鍵,試題培養了學生的規范答題能力.


科目:高中化學 來源: 題型:填空題
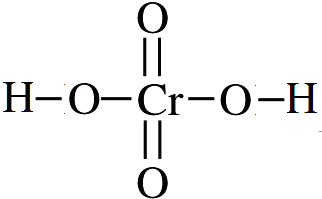 .
.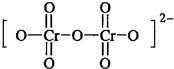
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
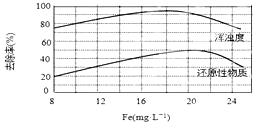
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
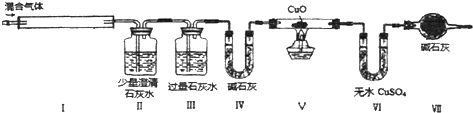
| A. | 混合氣體中一定有NO2和CO | |
| B. | 混合氣體中一定沒有H2和NH3 | |
| C. | 混合氣體中一定含有H2、NO、CO2、HCl四種氣體 | |
| D. | 不能確定混合氣體中是否有NH3 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
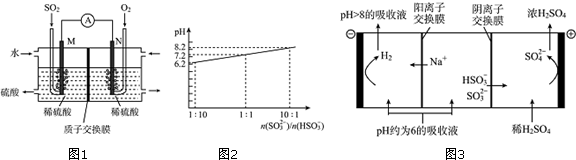
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1 | B. | 2 | C. | 3 | D. | 4 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 酸堿中和滴定時,用待測液潤洗錐形瓶. | |
| B. | 酸堿中和滴定時,用沖洗干凈的滴定管盛裝標準溶液 | |
| C. | 用NaOH標準溶液測定未知度的鹽酸時,選用酚酞作指示劑,實驗時不小心多加了幾滴 | |
| D. | 用標準鹽酸測定未知濃度NaOH結束實驗,酸式滴定管尖嘴部分有氣泡,開始實驗時無氣泡 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com