
【題目】向50 mL NaOH溶液中逐漸通入一定量的CO2(假設溶液體積不變),隨后取此溶液10 mL,將其稀釋至100 mL,并向此稀釋后的溶液中逐滴加入0.1 mol·L-1鹽酸,產生CO2氣體的體積(標準狀況下)與所加入鹽酸的體積關系如下圖所示。

(1) 寫出OA段所發生反應的離子方程式:______________。
(2)NaOH在吸收CO2后,所得溶液的溶質為____,其物質的量濃度之比為____。
(3)產生CO2的體積(標準狀況下)為____。
(4)原NaOH溶液的物質的量濃度為___。
【答案】(1)H++OH-===H2O; CO32-+H+===HCO3-
(2)NaOH和Na2CO31∶1 (3)0.056 L (4)0.75 mol·L
【解析】
試題(1)OA段消耗鹽酸50ml,生成CO2氣體需要鹽酸25ml,說明CO2與NaOH溶液反應生成了Na2CO3,并且NaOH過量,OA段發生的反應為:H++OH-=H2O;CO32-+H+=HCO3-,(2)AB段發生的反應為HCO3+H+=CO2+H2O,NaOH在吸收CO2后,所得溶液的溶質為NaOH和Na2CO3,與NaOH反應和與Na2CO3反應的HCl的量相等,正確;(3)根據AB段消耗了鹽酸25ml,可求出CO2的體積:0.025ml×0.1mol/L×22.4L/mol=0.056L;(4)B點時,恰好反應生成NaCl,根據Na元素守恒和Cl元素守恒,所取10mlNaOH溶液所含溶質的物質的量等于消耗的HCl的物質的量,0.01L×c(NaOH)=0.075L×0.1molL1,c(NaOH)=0.75molL1。


科目:高中化學 來源: 題型:
【題目】某興趣小組同學在實驗室用加熱1-丁醇、濃H2SO4和溴化鈉混合物的方法來制備1-溴丁烷,并檢驗反應的部分副產物,設計了如圖所示裝置,其中夾持儀器、加熱儀器及冷卻水管沒有畫出。
已知①NaBr+H2SO4=NaHSO4+HBr
②CH3(CH2)2CH2OH+HBr![]() CH3(CH2)2CH2Br+H2O
CH3(CH2)2CH2Br+H2O
兩反應都需加熱
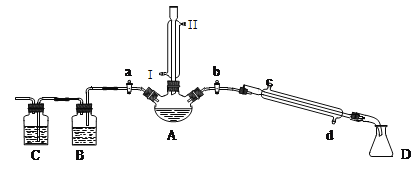
請根據實驗步驟,回答下列問題:
(1)關閉a和b、接通豎直冷凝管的冷凝水,給A加熱30分鐘,制備1-溴丁烷。豎直冷凝管接通冷凝水,出水口是_____(填“I”或“Ⅱ”);冷凝回流的主要目的是________。
(2)理論上,上述反應的副產物可能有:丁醚(CH3CH2CH2CH2-O-CH2CH2CH2CH3)、1-丁烯、溴化氫、硫酸氫鈉、水等。熄滅酒精燈,在豎直冷凝管上方塞上塞子并打開a,利用余熱繼續反應直至冷卻,通過B、C裝置檢驗部分副產物B、C中應盛放的試劑分別是石蕊和溴水,B裝置除用石蕊還可用______(填試劑名稱)寫出C裝置中主要的化學方程式:_________________________________________________。
有同學擬通過紅外光譜儀鑒定所得產物中是否含有“-CH2CH2CH2CH3”, 來確定副產物中存在丁醚。請你對該同學的觀點進行評價________________________________。
(3)為了進一步分離提純1-溴丁烷,該興趣小組同學查得相關有機物的數據如表所示:
物質 | 熔點/℃ | 沸點/℃ |
1-丁醇 | -89.5 | 117.3 |
1-溴丁烷 | -112.4 | 101.6 |
丁醚 | -95.3 | 142.4 |
1-丁烯 | -185.3 | -6.5 |
請你補充下列實驗步驟,直到分離出1-溴丁烷。
①待燒瓶冷卻后,拔去豎直的冷凝管;
②插上帶橡皮塞的溫度計;
③關閉_______,打開_______;
④接通冷凝管的冷凝水,使冷水從______處流入;
⑤迅速升高溫度至_______℃,收集所得餾分。
(4)若實驗中所取1-丁醇、NaBr分別為7.4 g、13.0 g,蒸出的粗產物經洗滌、干燥后再次蒸餾得到10.96 g 1-溴丁烷,則1-溴丁烷的產率是_____。(保留2位有效數字)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】下列有關海水綜合利用的說法正確的是( )
A.海水曬鹽后的母液中,直接加入CCl4可萃取Br2單質
B.從海水制海鹽主要是通過化學變化完成
C.電解氯化鈉溶液可以制得鈉單質和氯氣
D.電解熔融的氯化鎂可制備鎂單質和氯氣
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】根據如圖回答,下列說法正確的是
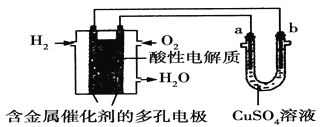
A. 此裝置若用于鐵表面鍍銅時,a為鐵。
B. 此裝置若用于電鍍銅時,硫酸銅溶液的濃度逐漸變小。
C. 燃料電池中正極反應為:O2+4e-+2H2O===4OH-
D. 若用該裝置進行粗銅的精煉,當有1 mol水生成時,b電極上增重63.5 g,a電極下方有部分重金屬泥。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】資料表明:赤熱銅能與NO2反應。某小組設計了如下實驗裝置進行探究,探究固體產物的成分,氣體產物是N2還是NO。
已知:酸性KMnO4溶液能氧化NO生成NO3ˉ;
NO和FeSO4溶液反應:NO+FeSO4=[Fe(NO)]SO4(棕色);
Cu2O+2H+=Cu+Cu2++H2O
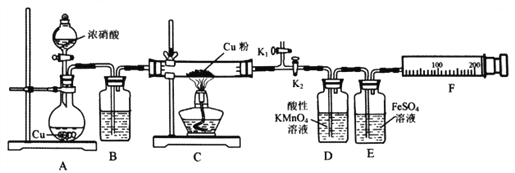
請回答下列問題:
(1)A中反應的化學方程式為________________________。
(2)檢查裝置氣密性,裝好藥品,然后實驗的正確操作順序是____________
①關閉K1,打開K2 ②打開分液漏斗活塞
③打開K1,關閉K2 ④點燃C處酒精燈
(3)實驗過程中,D裝置中的現象是____________,能否根據D裝置中的現象確認C中有無NO生成? ______,理由是________________________。
(4)E裝置的作用是____________。
(5)當銅粉完全反應后,實驗小組對反應后的固體成分提出以下猜想:①只有CuO;②只有Cu2O;有同學認為可通過簡單的定性實驗即可判斷猜想①是否成立,其實驗方法是_____________________。
(6)實驗中E裝置自始至終未顯棕色,小組最后通過定量實驗得到如下數據。
C裝置質量 | F裝置氣體的體積(已折算為標準狀況) | ||
玻管質量 | Cu質量 | 反應后(玻管+生成物) | |
mg | 1.92g | (m+2.24)g | 112mL |
據此寫出實驗時實際發生反應的化學方程式________________________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】合成氨工業對國民經濟和社會發展具有重要的意義。其原理為:N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-Q kJ/mol(Q>0)
2NH3(g) ΔH=-Q kJ/mol(Q>0)
據此回答以下問題:
(1)①該反應的化學平衡常數表達式為K=________。
②根據溫度對化學平衡的影響規律可知,對于該反應,溫度越高,其平衡常數的值越________。
(2)對于合成氨反應而言,下列有關圖像一定正確的是(選填序號)________。
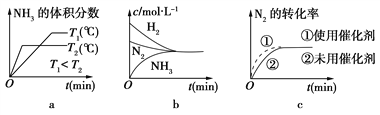
(3)某溫度下,若把2 mol N2與6 mol H2置于體積為1 L的密閉容器內,反應達到平衡狀態時,測得混合氣體中氨的體積分數為20%,則該溫度下反應的K=________(可用分數表示)。
(4)相同溫度下,有恒容密閉容器A和恒壓密閉容器B,兩容器中均充入1 mol N2和3 mol H2,此時兩容器的體積相等。在一定條件下反應達到平衡狀態,A中NH3的體積分數為a,放出熱量Q1 kJ;B中NH3的體積分數為b,放出熱量Q2 kJ。則:a________b(填“>”、“=”或“<”,下同),Q1________Q2,Q1_______Q。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】鎳是重要的合金元素,可制作鎳鉻、鎳鋁等合金,鎳也常用作有機加氫的催化劑及制取配合物。
(1)寫出基態Cr的簡化電子排布式__________,Cr中共有__________種不同能級的電子。
(2)Ni(CO)n與Fe(CO)5同屬金屬羰基配合物,形成配合物時,每個CO提供一對電子與金屬原子形成配位鍵,研究發現金屬原子的價電子和CO提供的電子總和等于18。
①Ni、C、O的電負性由大到小的順序為____________________。
② Ni(CO)n分子中n=__________。
③已知Ni2+和Fe2+的離子半徑分別為69pm和78pm,根據巖漿晶出規則熔融的NiO和FeO巖漿在冷卻過程中,NiO更容易先結晶,試解釋其原因____________________。
(3)檢定鎳、鈷、銅鈀等可用雙氰胺,化學式C2H4N4,其結構簡式如圖所示。雙氰胺分子中碳原子的雜化方式有__________,分子結構中鍵能最大的共價鍵是__________。
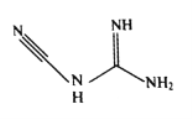
(4)鎳的晶體結構、鎳鋁合金的晶胞如圖所示。
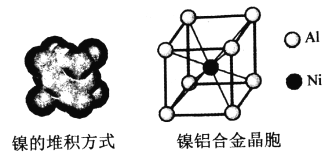
①鎳晶體的堆積方式為__________。
②已知Al的第一、第二電離能分別為:l1=578kJ/mol,l2=1817kJ/mol,簡述l2遠大于l1的原因__________________________________________________。
③已知:鎳鋁合金密度為dg/cm3,NA代表阿伏伽德羅常數,則鋁鎳的核間距為__________ pm。(用代數式表示)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】海帶中所含碘元素以碘離子(I-)的形式存在,經常食用海帶可以防治甲狀腺腫大。某同學設計實驗從海帶中提取碘,有如下操作:①濾液中滴加稀硫酸和雙氧水;②在海帶中加入少量酒精,使其燃燒為灰燼,在灰燼中加水攪拌;③加四氯化碳并振蕩;④過濾;⑤分液;⑥蒸餾。下列說法不正確的是( )

A. 實驗的合理操作順序是②④①③⑤⑥
B. 步驟②、④中都需要用到玻璃棒
C. 步驟①中雙氧水表現氧化性
D. 步驟⑥中所用裝置如右圖所示
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】碳、氧、氮、鎂、鉻、鐵、銅是幾種重要的元素,請回答下列問題:
(1)在第二周期的元素中,第一電離能介于B與N之間的元素有_________種。
(2)查閱相關資料發現MgO的熔點比CuO的熔點高得多,其原因是____________________。
(3)Fe與CO能形成一種重要的催化劑Fe(CO)5,該分子中σ鍵與π鍵個數比為______________。請寫出一個與CO互為等電子體的離子:____________________。
(4)金屬鉻是一種銀白色,極硬,耐腐蝕的金屬,鉻的化合物種類繁多,如:Cr2(SO4)3、K2Cr2O7以及配離子[Cr(H2O)3(NH3)3]3+。
①K2Cr2O7具有很強的氧化性,能直接將CH3CH2OH氧化成CH3COOH,試寫出基態鉻原子的價層電子排布式:_______________;CH3COOH分子中碳原子的雜化類型為_________________;乙醇和丙烷相對分子質量相近,但乙醇的熔、沸點比丙烷高很多,試解釋其主要原因:____________________________________。
②該配離子[Cr(H2O)3(NH3)3]3+中,中心離子的配位數為_______,NH3的VSEPR模型為_______。
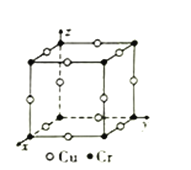
③圖為Cu-Cr形成的一種合金的晶胞(假設晶體中原子之間彼此相切),單獨屬于該晶胞的Cu原子共有三個,其原子坐標可分別表示為:(![]() ,0,0)、(0,
,0,0)、(0, ![]() ,0)、_______;已知晶胞中Cr和Cu原子間的最近距離為
,0)、_______;已知晶胞中Cr和Cu原子間的最近距離為![]() apm,則該晶體的密度為_______g·cm-3(用含a的代數式表示,設NA為阿伏加德羅常數的值)。
apm,則該晶體的密度為_______g·cm-3(用含a的代數式表示,設NA為阿伏加德羅常數的值)。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com