
蛇紋石是一種富鎂硅酸鹽礦物的總稱,因其顏色青綠相間酷似蛇皮而得名。蛇紋石可以看作由MgO、FeO和Fe2O3、Al2O3、SiO2組成。工業上由蛇紋石制取堿式碳酸鎂產品的流程如下: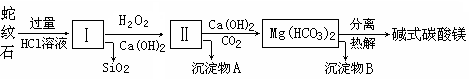
(1)蛇紋石加鹽酸溶解后,溶液里除了Mg2+、Al3+外,還含有的金屬離子是________。
(2)向Ⅰ中加入H2O2的作用是 ,有關離子方程式 ,加入Ca(OH)2時, 需要控制溶液pH在7~8之間(有關氫氧化物沉淀的pH見下表)。
| 氫氧化物 | Fe(OH)3 | Al(OH)3 | Mg(OH)2 |
| 開始沉淀pH | 1.5 | 3.3 | 9.4 |
(1)Fe2+、Fe3+
(2)將Fe2+氧化為Fe3+;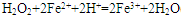 ;Al(OH)3溶解;Mg2+沉淀
;Al(OH)3溶解;Mg2+沉淀
(3)NaOH溶液
(4)3;1;3
解析試題分析:(1)蛇紋石礦可以看做MgO、FeO、Fe2O3、Al2O3、SiO2組成,蛇紋石加鹽酸溶解后,MgO、FeO、Fe2O3、Al2O3和HCl反應溶解,而SiO2和HCl不反應,不能溶解,故溶液里除了Mg2+、Al3+外,還含有Fe2+、Fe3+;(2)由(1)知,此時溶液中除了Mg2+外,還含有Fe3+、Fe2+、Al3+雜質,需除去,故向Ⅰ中加入H2O2的作用是將Fe2+氧化為Fe3+然后除去,因Fe3++3H2O?Fe(OH)3+3H+和Al3++3H2O?Al(OH)3+3H+,利用平衡移動的原理,消耗H+使上述水解平衡向正反應方向移動,除去Fe3+、Al3+,加Ca(OH)2需將溶液的pH控制在7~8,若pH過高,會導致生成的Al(OH)3發生反應Al(OH)3+OH-=AlO2-+2H2O溶解,Mg(OH)2在pH為9.4時開始沉淀,所以堿性增強Mg(OH)2會沉淀,同時Mg2+也因轉化為沉淀而損失。(3)從實驗步驟圖知:沉淀混合物為Fe(OH)3和Al(OH)3,紅色氧化物是沉淀物Fe(OH)3分解后得到的Fe2O3,所以得先加堿把Al(OH)3除掉,反應為:Al(OH)3+NaOH=NaAlO2+2H2O,然后過濾洗滌灼燒即可。(4)m(樣品)=18.2g,n(CO2)=0.15mol,m(CO2)=6.6g,m(MgO)=8.0g,堿式碳酸鎂分解:aMgCO3?bMg(OH)2?cH2O  (a+b)MgO+aCO2↑+(b+c)H2O↑,根據質量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,則m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得a:b:c=0.15:0.05:0.15=3:1:3。
(a+b)MgO+aCO2↑+(b+c)H2O↑,根據質量守恒得:m(H2O)=18.2g-6.6g-8.0g=3.6g,則m(MgO)═0.2mol,n(CO2)═0.15mol,n(H2O)═0.2mol,得a:b:c=0.15:0.05:0.15=3:1:3。
考點:考查鐵、鋁、硅等化合物的性質及化學式計算等內容。


 閱讀快車系列答案
閱讀快車系列答案科目:高中化學 來源: 題型:填空題
(14分)有三種金屬單質A、B、C,其中A的焰色反應為黃色,B、C是常見金屬。三種金屬單質A、B、C能與氣體甲、乙、丙及物質D、E、F、G、H之間發生如下轉化關系(圖中有些反應的產物和反應的條件沒有標出)。
請根據以上信息回答下列問題:
(1)寫出下列物質的化學式:
A_____________;H ______________; G___________;乙____________。
(2)寫出下列反應的化學方程式:
反應①________________________________;反應②_________________________________。
(3) 反應②中電子轉移的數目為6.02×1023個時消耗的氣體乙的物質的量為 mol
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(15分)用FeCl3酸性溶液脫除H2S后的廢液,通過控制電壓電解得以再生。某同學使用石墨電極,在不同電壓(x)下電解pH=1的0.1mol/LFeCl2溶液,研究廢液再生機理。記錄如下(a、b、c代表電壓值:)
| 序號 | 電壓/V | 陽極現象 | 檢驗陽極產物 |
| I | x≥a | 電極附近出現黃色,有氣泡產生 | 有Fe3+、有Cl2 |
| II | a>x≥b | 電極附近出現黃色,無氣泡產生 | 有Fe3+、無Cl2 |
| III | b>x>0 | 無明顯變化 | 無Fe3+、無Cl2 |
| 序號 | 電壓/V | 陽極現象 | 檢驗陽極產物 |
| IV | a>x≥c | 無明顯變化 | 有Cl2 |
| V | c>x≥b | 無明顯變化 | 無Cl2 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(14分)銅及其化合物在生產、生活中有廣泛的應用。
Ⅰ、銅可采用如下方法制備:
方法一:火法煉銅:Cu2S + O2  2Cu + SO2
2Cu + SO2
方法二:濕法煉銅:CuSO4 + Fe FeSO4 + Cu
FeSO4 + Cu
上述兩種方法中,你認為哪種方法更好 ,原因是 (寫出1條原因即可)。分別用火法煉銅與濕法煉銅生產640gCu,則轉移的電子數之比為 。
Ⅱ、印刷電路板上使用的銅需要回收利用。
用FeCl3溶液浸泡印刷電路板制備CuCl2·2H2O晶體,實驗室模擬回收過程如下: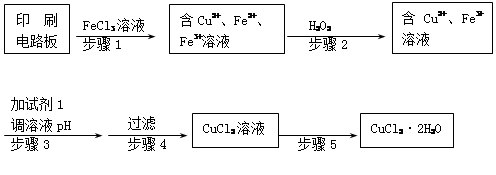
①步驟2中反應的離子方程式是 。
②步驟5中蒸發濃縮CuCl2溶液時,要滴加濃鹽酸,目的是________________ (用化學方程式并結合簡要文字說明),再經冷卻、結晶、過濾,得到CuCl2·2H2O晶體。
③步驟4中洗滌沉淀的操作為
④步驟3中可選用的“試劑1”是 (寫出一種即可),目的是使溶液的pH升高到4,此時Fe3+濃度為 [Ksp(Fe(OH)3)=4×10-38]。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
氯化鐵和高鐵酸鉀都是常見的水處理劑。下圖為制備氯化鐵及進一步氧化制備高鐵酸鉀的工藝流程。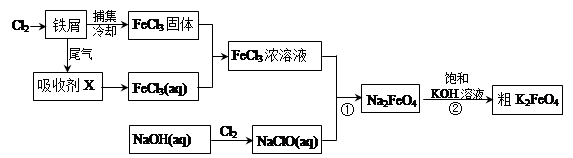
請回答下列問題:
(1)氯化鐵有多種用途:
①氯化鐵做凈水劑。請用離子方程式表示其原理____________ __________;
②工業上常用FeCl3溶液腐蝕銅印刷線路板。這是利用了FeCl3較強的__________性。
(2)吸收劑X的化學式為 。為檢驗吸收劑是否已完全轉化為FeCl3溶液,有人設計用酸性高錳酸鉀溶液,但很快被否定,理由是(用離子方程式表示) 。正確的檢驗方法是:取少量待測液,加入 (寫化學式)溶液,若無深藍色沉淀產生,則證明轉化完全。
(3)堿性條件下反應①的離子方程式為____________________________________。
(4)過程②將混合溶液攪拌半小時,靜置,抽濾獲得粗產品。該反應的化學方程式為2KOH+Na2FeO4  K2FeO4+2NaOH,請根據相關反應原理分析反應能發生的原因 。
K2FeO4+2NaOH,請根據相關反應原理分析反應能發生的原因 。
(5)將粗K2FeO4產品經重結晶、過濾、 、 ,即得較純凈的K2FeO4。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
實驗題(14分):Ⅰ、HCOOH是一種無色、易揮發的液體,某學習小組參照: 原理,用下列儀器(加熱及固定裝置省略)制備干燥、純凈的CO,并用CO還原CuO粉末。
原理,用下列儀器(加熱及固定裝置省略)制備干燥、純凈的CO,并用CO還原CuO粉末。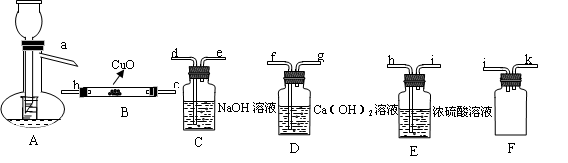
(1)若所制氣體流向從左向右時,上述儀器連接為: A→( ) →( )→( )→( ) →( )
(2)A裝置中小試管的作用(至少答兩條):
① 。② 。
(3)證明HCOOH受熱產物中有CO的現象為: 。
(4)本實驗有3處用到酒精燈,除A、B處外,還缺一個酒精燈,應放在 處.
Ⅱ、學習小組查閱資料知:
Cu的顏色為紅色或紫紅色,而Cu2O的顏色也為紅色或磚紅色。②4CuO 2 Cu2O + O2↑;③ Cu2O +2H+
2 Cu2O + O2↑;③ Cu2O +2H+
= Cu+Cu2+ + H2O ;因此對CO充分還原CuO后所得紅色固體是否含有Cu2O進行了認真的研究,提出下列設計方案:
方案①:取該紅色固體溶于足量稀硝酸中,觀察溶液顏色的變化。
方案②:取該紅色固體溶于足量稀硫酸中,觀察溶液顏色的變化。
(5)寫出Cu2O與稀硝酸反應的化學方程式: 。
(6)請你評價方案②的合理性,并簡述理由:方案②: ,理由: 。
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
切開的金屬Na暴露在空氣中,其變化過程如下:
(1)反應Ⅰ的反應過程與能量變化的關系如下:
① 反應Ⅰ 是 反應(填“放熱”或“吸熱”),判斷依據是 。
② 1 mol Na(s)全部氧化成Na2O(s)的熱化學方程式是 。
(2)反應Ⅱ是Na2O與水的反應,其產物的電子式是 。
(3)白色粉末為Na2CO3。將其溶于水配制為0.1 mol/L Na2CO3溶液,下列說法正確的是 (填字母)。
| A.升高溫度,溶液的pH降低 |
| B.c(OH-)-c (H+)=c (HCO3-)+2 c (H2CO3) |
| C.加入少量NaOH固體,c (CO32―)與c (Na+)均增大 |
| D.c (Na+) > c (CO32―) > c (HCO3―) > c(OH―) > c (H+) |
 Ni + 2NaCl。其正極反應式是_____。
Ni + 2NaCl。其正極反應式是_____。查看答案和解析>>
科目:高中化學 來源: 題型:填空題
(1)高溫電解技術能高效實現CO2(g) + H2O(g) ="CO(g)" + H2(g) +O2(g) ,工作原理示意圖如下: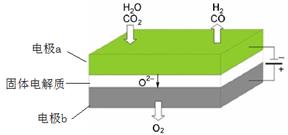
①電極b發生 (填“氧化”或“還原”)反應。
②CO2在電極a放電的反應式是 。
(2)工業上用某礦渣(含有Cu2O、Al2O3、Fe2O3、SiO2)提取銅的操作流程如下: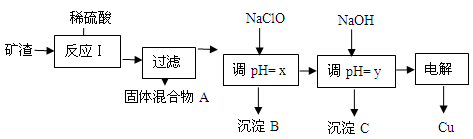
已知: Cu2O + 2H+ =" Cu" + Cu2+ + H2O
| 沉淀物 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀pH | 5.4 | 4.0 | 1.1 | 5.8 |
| 沉淀完全pH | 6.7 | 5.2 | 3.2 | 8.8 |
 HClO,ClO-消耗H+,從而達到調節pH的目的
HClO,ClO-消耗H+,從而達到調節pH的目的 HClO+OH-,OH-消耗H+ ,從而達到調節pH的目的
HClO+OH-,OH-消耗H+ ,從而達到調節pH的目的查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com