
(16)為了探究過氧化鈉的強氧化性,某研究性學習小組設計了如圖所示的實驗裝置。

實驗步驟及現象如下:
①檢查裝置氣密性后,裝入藥品并連接儀器。
②緩慢通入一定量的N2后,將裝置D連接好(導管末端未伸入集氣瓶中),再向圓底燒瓶中緩慢滴加濃
鹽酸,劇烈反應,有氣體產生。
③一段時間后,將導管末端伸入集氣瓶中收集氣體。裝置D中收集到能使帶火星的木條復燃的無色氣體。
④反應結束后,關閉分液漏斗的活塞,再通入一定量的N2,至裝置中氣體無色。
回答下列問題:
(1)裝置B中濕潤的紅色紙條退色,證明A中反應有 (填化學式)生成。若B中改放濕潤的淀粉KI試紙,僅憑試紙變藍的現象不能證明上述結論,請用離子方程式說明原因 。
(2)裝置C的作用是 。
(3)甲同學認為O2是Na2O2被鹽酸中的HCl還原所得。乙同學認為此結論不正確,他可能的理由為① ;② 。
(4)實驗證明,Na2O2與干燥的HCl能反應,完成并配平該化學方程式。
Na2O2+ HCl=== Cl2+ NaCl+H2O
該反應 (填“能”或“不能”)用于實驗室快速制取純凈的Cl2,理由是 (要求答出兩點)。
 陽光同學一線名師全優好卷系列答案
陽光同學一線名師全優好卷系列答案科目:高中化學 來源:2014-2015學年山東省濟南外國語學校高三上學期期中測試化學試卷(解析版) 題型:選擇題
醋酸溶液中存在電離平衡:CH3COOH H++ CH3COO-,下列敘述不正確的是
H++ CH3COO-,下列敘述不正確的是
A.醋酸溶液中離子濃度的關系滿足:c(H+)= c(OH-)+ c(CH3COO-)
B.0.10mol/L的CH3COOH溶液中加水稀釋,溶液中c(OH-)減小
C.CH3COOH溶液中加少量的CH3COONa固體,平衡逆向移動
D.常溫下pH=2的醋酸溶液與pH=12的NaOH溶液等體積混合后,溶液的pH<7
查看答案和解析>>
科目:高中化學 來源:2015-2016學年內蒙古巴彥淖爾高二上10月月考化學試卷(解析版) 題型:選擇題
可逆反應aX+2Y(g)?2Z(g)在一定條件下的達到平衡后,t1和t2時各改變某一種外界條件,化學反應速率(v)﹣時間(t)圖象如圖。則下列說法中正確的是

A. 若X是固體,則t1時一定是增大了容器的壓強
B. 若X是氣體,則t2時不可能是減小容器壓強
C. 若X是固體,則t1時可能是增大了X的質量
D. 若t2時采用了降溫措施,則該反應的正反應方向△H>0
查看答案和解析>>
科目:高中化學 來源:2015-2016學年河北省高二上學期第一次月考化學試卷(解析版) 題型:選擇題
在密閉容器中進行的可逆反應,A與B反應生成C,其反應速率分別用v(A)、v(B)、v(C)(mol·L-1·s-1)表示,且v(A)、v(B)、v(C)之間有以下關系:v(B)=3v(A),3v(C)=2v(B),則此反應可表示為
A.2A+3B 2C B.A+3B
2C B.A+3B 2C
2C
C.3A+B 2C D.A+B
2C D.A+B C
C
查看答案和解析>>
科目:高中化學 來源:2015-2016學年吉林省高二上學期9月月考化學試卷(解析版) 題型:選擇題
一定溫度下,在2L的密閉容器中,X、Y、Z三種氣體的量隨時間變化的曲線如下圖所示:
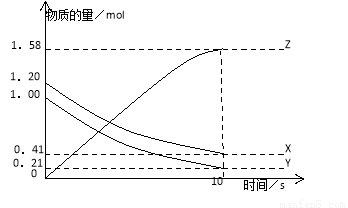
下列描述正確的是
A.反應開始到10s,用Z表示的反應速率為0.158mol/(L·s)
B.反應開始到10s,X的物質的量濃度為減少了0.79mol/L
C.反應開始到10s時,Y的轉化率為79.0%
D.反應的化學方程式為:X(g)+ Y(g) Z(g)
Z(g)
查看答案和解析>>
科目:高中化學 來源:2016屆福建省莆田市高三上學期第一次月考化學試卷(解析版) 題型:選擇題
下列能夠檢驗出KI中是否含有Br-的實驗是
A.加入足量的新制氯水,溶液變色則有Br-
B.加入酸性KMnO4溶液,觀察溶液顏色是否褪去
C.加入少量的碘水,再加入CCl4振蕩,有機層有色,則有Br-
D.加入足量FeCl3溶液,用CCl4萃取后,取無色的水層并加入氯水,溶液呈橙色,則含有Br-
查看答案和解析>>
科目:高中化學 來源:2016屆江西省高三上學期第一次月考化學試卷(解析版) 題型:填空題
現有下列8種物質:①Na2CO3、②NaHCO3、③HCl、④NH4HCO3、⑤C2H5OH、⑥Al、⑦食鹽水、⑧CH3COOH。
(1)上述物質中屬于強電解質的是_________________(填序號),既能跟鹽酸反應又能跟NaOH溶液反應的是______________(填序號)。
(2)上述②的水溶液呈堿性的原因是(用離子方程式表示)__________________________。
(3)④與足量的NaOH濃溶液在加熱條件下反應的離子方程式_______________________。
查看答案和解析>>
科目:高中化學 來源:2016屆上海市高三上學期摸底測試化學試卷(解析版) 題型:選擇題
今有乙酸和乙酸甲酯的混和物中,測得含碳的質量百分數為X,則混和物中氧的質量百分數為
A.(1-X)/7 B.6(1-X)/7 C.1-7X/6 D.無法計算
查看答案和解析>>
科目:高中化學 來源:2016屆湖南省衡陽市高三上學期第二次月考化學試卷(解析版) 題型:填空題
(14分)Ⅰ.氫化亞銅(CuH)是一種難溶物質,用CuSO4溶液和“另一物質”在40~50℃時反應可生成它。CuH具有的性質有:不穩定,易分解;在氯氣中能燃燒;與稀鹽酸反應能生成氣體;Cu+在酸性條件下發生的反應是:2Cu+===Cu2++Cu.根據以上信息,結合自己所掌握的化學知識,回答下列問題:
(1)用CuSO4溶液和“另一物質”制CuH的反應中,用氧化還原觀點分析,這“另一物質”在反應中作______________(填“氧化劑”或“還原劑” ).
).
(2)寫出CuH在氯氣中燃燒的化學反應方程式:________________________
(3)CuH溶解在稀鹽酸中生成的氣體是_______________(填化學式).
(4)如果把CuH溶解在足量的稀硝酸中生成的氣體只有NO,請寫出CuH溶解在足量稀硝酸中反應的離子方程式:__________________________
Ⅱ.某強酸性反應體系中,反應物和生成物共六種物質:PbO2、PbSO4(難溶鹽)、Pb(MnO4)2(強電解質)、H2O、X(水溶液呈無色)、H2SO4,已知X是一種鹽,且0.1 mol X在該反應中失去3.01×1023個電子。
(1)寫出該反應的化學方程式:_____________________________________;
(2)若有9.8 g H2SO4參加反應,則轉移電子的物質的量為______________;
(3)本反應體系中,若用濃鹽酸代替硫酸,用離子方程式表示 后果:___________________。
后果:___________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com