
| A. | 物質的量濃度相等的碳酸氫鋇溶液和氫氧化鈉溶液等體積混合Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O | |
| B. | NaHSO4溶液中滴加入Ba(OH)2溶液至中性:2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O | |
| C. | 以石墨作電極電解氯化鎂溶液:2Cl-+2H2O═2OH-+H2↑+Cl2↑ | |
| D. | 碳酸氫鈉溶液加入氯化鋁溶液 3HCO3-+Al3+?3CO2↑+Al(OH)3↓ |
分析 A.物質的量濃度相等的碳酸氫鋇溶液和氫氧化鈉溶液等體積混合,反應的n(HCO3-):n(OH-)=1:1,氫氧化鈉不足;
B.NaHSO4溶液中滴加入Ba(OH)2溶液至中性,生成硫酸鋇沉淀和水;
C.電解氯化鎂溶液生成氫氣、氯氣和氫氧化鎂沉淀;
D.碳酸氫鈉溶液加入氯化鋁溶液發生互促水解,比較徹底.
解答 解:A.物質的量濃度相等的碳酸氫鋇溶液和氫氧化鈉溶液等體積混合,應滿足n(HCO3-):n(OH-)=1:1,離子方程式為Ba2++HCO3-+OH-=BaCO3↓+H2O,故A錯誤;
B.NaHSO4溶液中滴加入Ba(OH)2溶液至中性,生成硫酸鋇沉淀和水,為2H++Ba2++2OH-+SO42-=BaSO4↓+2H2O,故B正確;
C.電解氯化鎂溶液生成氫氣、氯氣和氫氧化鎂沉淀,為Mg2++2H2O+2Cl-$\frac{\underline{\;電解\;}}{\;}$-H2↑+Cl2↑+Mg(OH)2↓,故C錯誤;
D.碳酸氫鈉溶液加入氯化鋁溶液發生互促水解,比較徹底,不用可逆符號,應為3HCO3-+Al3+=3CO2↑+Al(OH)3↓,故D錯誤.
故選B.
點評 本題考查了離子方程式正誤判斷,為考試熱點,難溶物、弱電解質、氧化物、氣體、絡合物等都要寫化學式,要注意遵循轉移電子守恒、原子守恒及電荷守恒,題目難度不大.


科目:高中化學 來源: 題型:解答題
 某研究性學習小組欲測定室溫下(25℃、101kPa)的氣體摩爾體積,請回答以下問題.該小組設計的簡易實驗裝置如圖所示:該實驗的主要操作步驟如下:
某研究性學習小組欲測定室溫下(25℃、101kPa)的氣體摩爾體積,請回答以下問題.該小組設計的簡易實驗裝置如圖所示:該實驗的主要操作步驟如下:查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 表為元素周期表的一部分,請參照元素①-⑨在表中的位置,回答下列問題:
表為元素周期表的一部分,請參照元素①-⑨在表中的位置,回答下列問題: | IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑨ | ⑥ | ⑦ | ⑧ |
 ,該物質與溴水發生加成反應的化學方程式是CH2=CH2+Br2→BrCH2CH2Br.
,該物質與溴水發生加成反應的化學方程式是CH2=CH2+Br2→BrCH2CH2Br.
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe3+ Na+ S2- Cl- | B. | Al3+ NH4+ AlO2- NO3- | ||
| C. | NH4+ Mg2+ SO42- Cl- | D. | H+ Na+ HCO3- SiO32- |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
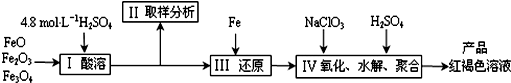
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為實驗室蒸餾自來水得到少量蒸餾水的裝置示意圖如圖2,請根據圖示回答下列問題:
如圖為實驗室蒸餾自來水得到少量蒸餾水的裝置示意圖如圖2,請根據圖示回答下列問題:查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com