
【題目】下列試劑不能用來鑒別乙醇和乙酸的是
A. 紫色石蕊試液B. 碳酸鈉溶液C. 蒸餾水D. 酸性高錳酸鉀溶液
 小學奪冠AB卷系列答案
小學奪冠AB卷系列答案 ABC考王全優卷系列答案
ABC考王全優卷系列答案科目:高中化學 來源: 題型:
【題目】在等體積的NaCl、MgCl2、A1C13三種溶液中,分別加入等量的AgNO3溶液,恰好都完全反應,則以上三種溶液的物質的量濃度之比為
A. 1:2:3 B. 3:2:1 C. 1:1:1 D. 6:3:2
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】某溫度下,相同pH值的鹽酸和醋酸溶液分別加水稀釋,平衡pH值隨溶液體積變化的曲線如圖所示.據圖判斷正確的是( ) 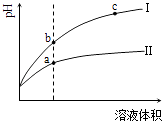
A.Ⅱ為鹽酸稀釋時的pH值變化曲線
B.b點溶液的導電性比c點溶液的導電性強
C.a點Kw的數值比c點Kw的數值大
D.b點酸的總濃度大于a點酸的總濃度
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】銅的+1價化合物如Cu2O、CuCl都是重要的化工產品,研究它們的制備及其性質具有重大的現實意義.
(1)Cu2O是一種具有獨特光、磁特性的紅棕色p型半導體材料.
(i)工業上可以用新制Cu(OH)2懸濁液與液態肼(N2H4)反應制備Cu2O,同時放出N2 , 下列對應的化學反應方程式:
(ii)已知常溫下,溶液中的Cu+易在酸性條件下發生反應:2Cu+=Cu2++Cu.寫出稀硫酸與Cu2O反應的離子方程式
(2)氯化亞銅(CuCl)微溶欲水,不溶于酒精,在潮濕空氣中易水解氧化.某課外小組以某工業廢渣(主要成分為硅,銅,碳等)為原料制備CuCl的流程示意圖如圖:
(i)“濾渣”的主要成分為(填化學式).
(ii)“還原”過程中SO32﹣將Cu2+還原為CuCl,請寫出反應的例子方程式: , 亞硫酸鈉需適當過量,目的有 .
(iii)操作Ⅰ和操作Ⅱ所用的玻璃儀器為 . 操作Ⅲ包括對濾餅的醇洗,干燥,使用無水乙醇代替水進行洗滌的優點是
(iv)CuCl是共價化合物,經測定其蒸氣對H2的相對密度為99.5,測它的準確的分子式為
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】若氖原子質量是ag,12C的原子質量是bg,NA是阿伏伽德羅常數的值,下列說法不正確的是( )
A.該氖原子的相對原子質量是12 ![]()
B.該氖原子的摩爾質量是aNAg
C.Wg該氖原子的物質的量是 ![]() mol
mol
D.Wg該氖原子所含質子數是10W/a
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】850℃時反應A(g)+B(g) ![]() C(g)+D(g)△H<0,該溫度下平衡常數K=l.t℃時,在一定體積的容器中,通入一定量的A和B發生化學反應,各物質濃度隨時間變化如下表:t℃時物質的濃度(molL﹣1)變化
C(g)+D(g)△H<0,該溫度下平衡常數K=l.t℃時,在一定體積的容器中,通入一定量的A和B發生化學反應,各物質濃度隨時間變化如下表:t℃時物質的濃度(molL﹣1)變化
時間/min | A | B | C | D |
0 | 0.200 | 0.300 | 0 | 0 |
2 | 0.138 | 0.238 | 0.062 | 0.062 |
3 | 0.100 | 0.200 | 0.100 | 0.100 |
4 | 0.100 | 0.200 | 0.100 | 0.100 |
5 | 0.116 | 0.216 | 0.084 | |
6 | 0.096 | 0.266 | 0.104 |
(1)計算t℃該化學反應的平衡常數:
(2)t℃850℃(填大于、小于或等于).判斷依據是
(3)反應在4min~5min之間,平衡(填“向左”、“向右”或“不”)移動,可能的原因是
a.增加A的濃度 b.增加D的濃度 c.加壓 d.使用催化劑
(4)某溫度下反應C(g)+D(g)A(g)+B(g)的平衡濃度符合c(C)c(D)=2c(A)c(B),則此時的溫度850℃(填大于、小于或等于).
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】霧霾嚴重影響人們的生活,汽車尾氣排放是造成霧霾天氣的重要原因之一.已知汽車尾氣排放時容易發生以下反應: 
①N2(g)+O2(g)2NO(g)△H1=a kJmol﹣1
②2NO(g)+O2(g)2NO2(g)△H2=b kJmol﹣1
③CO(g)+ ![]() O2(g)CO2(g)△H3=c kJmol﹣1
O2(g)CO2(g)△H3=c kJmol﹣1
④2CO(g)+2NO(g)N2(g)+2CO2(g)△H4
請回答下列問題:
(1)根據反應①②③,確定反應④中△H4=kJmol﹣1 .
(2)對于氣體參與的反應,表示平衡常數Kp時用氣體組分(B)的平衡壓強p(B)代替該氣體物質的量濃度c(B),則反應①的Kp=(用表達式表示).
(3)下列情況能說明反應②已達平衡狀態的是(填編號).
A.單位時間內生成1mol NO2的同時消耗了lmol NO
B.在恒溫恒容的容器中,混合氣體的密度保持不變
C.在絕熱恒容的容器中,反應的平衡常數不再變化
D.在恒溫恒壓的容器中,NO的體積分數保持不變
(4)探究反應④中NO的平衡轉化率與壓強、溫度的關系,得到如圖1所示的曲線.試分析實際化工生產中不采用高壓的原因 .
(5)探究反應④中平衡時CO2的體積分數與反應物中 ![]() 的比值、溫度的關系,得到如圖2所示的曲線.
的比值、溫度的關系,得到如圖2所示的曲線.
①在X、Y、Z三點中,CO的轉化率從大到小的順序是 .
②若保持其他條件不變,請在圖2中,畫出溫度為T2(T2<T1)時的變化趨勢曲線.
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com