
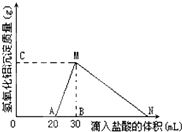
 在10mL含有AlO2-離子的溶液中逐滴加入1mol/L的鹽酸,所得Al(OH)3沉淀質量和所加鹽酸的體積關系如圖所示.問:
在10mL含有AlO2-離子的溶液中逐滴加入1mol/L的鹽酸,所得Al(OH)3沉淀質量和所加鹽酸的體積關系如圖所示.問:分析 (1)由圖可知,滴加鹽酸開始不產生沉淀,故溶液中還含有OH-,開始加入的20mL鹽酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)等于20mL鹽酸中n(HCl);
(2)由圖可知,MN段是氫氧化鋁與鹽酸反應生成氯化鋁與水;
(3)根據n=$\frac{m}{M}$計算出氫氧化鋁的物質的量,根據方程式計算溶液中n(AlO2-),再根據c=$\frac{n}{V}$計算濃度;
(4)由圖可知,加鹽酸到點N處,氫氧化鋁恰好完全溶解,此時溶液中陰離子為Cl-,根據電荷守恒可知n(Cl-)=n(AlO2-)+n(OH-),據此計算氫氧化鋁溶解需要鹽酸的物質的量,進而計算體積.
解答 解:(1)由圖可知,滴加鹽酸開始不產生沉淀,故溶液中還含有OH-,開始加入的20mL鹽酸用于中和OH-,由于H++OH-=H2O,故溶液中n(OH-)=n(H+)=0.02L×1mol/L=0.02mol,
故答案為:0.02;OH-;
(2)由圖可知,MN段是氫氧化鋁與鹽酸反應生成氯化鋁與水,反應離子方程式為Al(OH)3+3H+=Al3++3H2O,
故答案為:Al(OH)3+3H+=Al3++3H2O;
(3)C(或M)點的縱坐標為0.78,則C點生成氫氧化鋁沉淀的物質的量為:$\frac{0.78g}{78g/mol}$=0.01mol,
根據反應AlO2-+H++H2O═Al(OH)3↓可知溶液中n(AlO2-)=n(H+)=0.01L×1mol/L=0.01mol,
故c(AlO2-)=$\frac{0.01mol}{0.01L}$=1mol/L,
故答案為:1mol;
(4)由圖可知,加鹽酸到點N處,氫氧化鋁恰好完全溶解,此時溶液中陰離子為Cl-,根據電荷守恒可知n(Cl-)=n(AlO2-)+n(OH-)=0.01mol+0.02mol=0.03mol,故此階段消耗的鹽酸的體積為$\frac{0.03mol}{1mol/L}$=0.03L=30mL,故N點滴入的HCl溶液體積共為30mL+30mL=60mL,
故答案為:60.
點評 本題考查鋁及其化合物的性質、有關圖象的化學計算等,題目難度中等,明確各階段發生的反應是解題的關鍵,試題側重考查學生的分析、理解能力及化學計算能力.


科目:高中化學 來源: 題型:選擇題
| A. | 玻璃容器可長期盛放各種酸 | |
| B. | 純堿可用于清洗油污 | |
| C. | 濃氨水可檢驗氯氣管道泄漏 | |
| D. | 水玻璃是制備硅膠和木材防火劑的原料 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
 I:能源是人類生活和社會發展的基礎,地球上最基本的能源是太陽能,大自然利用這一能源最成功的是植物的光合作用.氫氣被人們看作理想的綠色能源,己知氫氣的熱值是143kJ•g-1(熱值指的是在一定條件下單位質量的物質完全燃燒所放出的熱量,氫氣轉化為液態水.)請寫出氫氣燃燒的熱化學方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.
I:能源是人類生活和社會發展的基礎,地球上最基本的能源是太陽能,大自然利用這一能源最成功的是植物的光合作用.氫氣被人們看作理想的綠色能源,己知氫氣的熱值是143kJ•g-1(熱值指的是在一定條件下單位質量的物質完全燃燒所放出的熱量,氫氣轉化為液態水.)請寫出氫氣燃燒的熱化學方程式H2(g)+$\frac{1}{2}$O2(g)=H2O(1);△H=-286kJ•mol-1或2H2(g)+O2(g)=2H2O(l)△H=-572KJ•mol-1.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 醛基的結構簡式-COH | B. | 丙烷分子的比例模型為: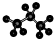 | ||
| C. | 四氯化碳分子的電子式為 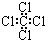 | D. | 2-乙基-1,3-丁二烯的鍵線式 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 具有相同數目的原子 | B. | 都占22.4 L | ||
| C. | 具有相同數目的分子 | D. | 具有相同摩爾質量 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 現有A、B、C三種短周期元素,原子序數依次遞增.A與C的質子數之和為27,最外層電子數之差為5;0.9g單質B與足量鹽酸反應,收集到氣體1.12L(標準狀況).請回答下列問題:
現有A、B、C三種短周期元素,原子序數依次遞增.A與C的質子數之和為27,最外層電子數之差為5;0.9g單質B與足量鹽酸反應,收集到氣體1.12L(標準狀況).請回答下列問題:查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com