
(10分)(1)反應Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常數為K1
FeO(s)+CO(g) △H1,平衡常數為K1
反應Fe(s)+H2O(g) FeO(s)+H2(g)
△H2,平衡常數為K2
FeO(s)+H2(g)
△H2,平衡常數為K2
在不同溫度時K1、K2的值如下表:
|
|
700℃ |
900℃ |
|
K1 |
1.47 |
2.15 |
|
K2 |
2.38 |
1.67 |
①反應 CO2(g) + H2(g) CO(g) + H2O(g) △H ,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g)
+ H2(g)
CO(g) + H2O(g) △H ,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g)
+ H2(g) CO(g) + H2O(g)是
反應(填“吸熱”或“放熱”)。
CO(g) + H2O(g)是
反應(填“吸熱”或“放熱”)。
②能判斷CO2(g)
+ H2(g) CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應Fe(s)+CO2(g) FeO(s)+CO(g)
△H > 0,CO2的濃度與時間的關系如圖所示:
FeO(s)+CO(g)
△H > 0,CO2的濃度與時間的關系如圖所示:
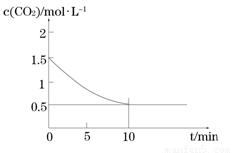
① 該條件下反應的平衡常數為 ;若鐵粉足量,CO2的起始濃度為2.0 mol·L-1,則平衡時CO2的濃度 mol·L-1。
②下列措施中能使平衡時 增大的是
(填序號)
增大的是
(填序號)
A.升高溫度 B.增大壓強
C.充入一定量的CO2 D.再加入一定量鐵粉
(共10分)
(1)① △H1-△H2 (1分) ; (1分);吸熱(1分) ②B、C(各1分,共2分)
(1分);吸熱(1分) ②B、C(各1分,共2分)
(2)① 2.0(2分) ;0.67(或2/3) (2分) ② A (1分)
【解析】(1)①由蓋斯定律可知,△H=△H1-△H2 ; K=
可知隨著溫度的升高,K值增大,即平衡向正向移動,正反應是吸熱反應。
②CO2(g)
+ H2(g) CO(g) + H2O(g)是一個兩邊氣體系數相同的反應,故A不正確;而D選項與是否到達平衡沒有什么關系,排除。
CO(g) + H2O(g)是一個兩邊氣體系數相同的反應,故A不正確;而D選項與是否到達平衡沒有什么關系,排除。
(2)①Fe(s)+CO2(g) FeO(s)+CO(g)
FeO(s)+CO(g)
初始: 1.5 0
平衡: 0.5 1mol/L
故可求出K=c(CO)/c(CO2)=2
②即平衡右移即可滿足題意。增大壓強平衡不移動,排除;鐵粉為固體,不會影響平衡的移動;增加CO2 必然導致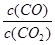 變小。
變小。


科目:高中化學 來源: 題型:
(10分)(1)反應Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常數為K1
反應Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常數為K2
在不同溫度時K1、K2的值如下表:
|
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反應 CO2(g) + H2(g)CO(g) + H2O(g) △H ,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g)+ H2(g)
CO(g) + H2O(g)是 反應(填“吸熱”或“放熱”)。
②能判斷CO2(g)+ H2(g)CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)= v逆(H2O) D.c(CO)=c(CO2)
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應Fe(s)+CO2(g)FeO(s)+CO(g)△H > 0,CO2的濃度與時間的關系如圖所示:
①該條件下反應的平衡常數為 ;若鐵粉足量,CO2的起始濃度為2.0mol·L-1,則平衡時CO2的濃度 mol·L-1。
②下列措施中能使平衡時增大的是 (填序號)
A.升高溫度 B.增大壓強
C.充入一定量的CO2 D.再加入一定量鐵粉
查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)(1)反應Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常數為K1
反應Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常數為K2
在不同溫度時K1、K2的值如下表:
|
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反應 CO2(g) + H2(g)CO(g) + H2O(g) △H ,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g)+ H2(g)
CO(g) + H2O(g)是 反應(填“吸熱”或“放熱”)。
②能判斷CO2(g)+ H2(g)CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)= v逆(H2O) D.c(CO)=c(CO2)
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應Fe(s)+CO2(g)FeO(s)+CO(g)△H > 0,CO2的濃度與時間的關系如圖所示:
①該條件下反應的平衡常數為 ;若鐵粉足量,CO2的起始濃度為2.0mol·L-1,則平衡時CO2的濃度 mol·L-1。
②下列措施中能使平衡時增大的是 (填序號)
A.升高溫度 B.增大壓強
C.充入一定量的CO2 D.再加入一定量鐵粉
查看答案和解析>>
科目:高中化學 來源: 題型:
(10分)(1)反應Fe(s)+CO2(g)FeO(s)+CO(g) △H1,平衡常數為K1
反應Fe(s)+H2O(g)FeO(s)+H2(g) △H2,平衡常數為K2
在不同溫度時K1、K2的值如下表:
|
| 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
①反應 CO2(g) + H2(g)CO(g) + H2O(g) △H ,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g)+ H2(g)
CO(g) + H2O(g)是 反應(填“吸熱”或“放熱”)。
②能判斷CO2(g)+ H2(g)CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)= v逆(H2O) D.c(CO)=c(CO2)
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應Fe(s)+CO2(g)FeO(s)+CO(g)△H > 0,CO2的濃度與時間的關系如圖所示:
①該條件下反應的平衡常數為 ;若鐵粉足量,CO2的起始濃度為2.0mol·L-1,則平衡時CO2的濃度 mol·L-1。
②下列措施中能使平衡時增大的是 (填序號)
A.升高溫度 B.增大壓強
C.充入一定量的CO2 D.再加入一定量鐵粉
查看答案和解析>>
科目:高中化學 來源:2011-2012學年浙江省杭州第二中學高二下學期期中考試化學試卷(帶解析) 題型:填空題
(10分)(1)反應Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常數為K1
FeO(s)+CO(g) △H1,平衡常數為K1
反應Fe(s)+H2O(g) FeO(s)+H2(g) △H2,平衡常數為K2
FeO(s)+H2(g) △H2,平衡常數為K2
在不同溫度時K1、K2的值如下表:
| | 700℃ | 900℃ |
| K1 | 1.47 | 2.15 |
| K2 | 2.38 | 1.67 |
 CO(g) + H2O(g) △H,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g) + H2(g)
CO(g) + H2O(g) △H,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g) + H2(g) CO(g) + H2O(g)是 反應(填“吸熱”或“放熱”)。
CO(g) + H2O(g)是 反應(填“吸熱”或“放熱”)。 CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。 FeO(s)+CO(g) △H > 0,CO2的濃度與時間的關系如圖所示:
FeO(s)+CO(g) △H > 0,CO2的濃度與時間的關系如圖所示:
 增大的是 (填序號)
增大的是 (填序號)查看答案和解析>>
科目:高中化學 來源:2011-2012學年高三上學期化學一輪復習《化學家眼中的物質世界》專題綜合測試(蘇教版) 題型:填空題
(10分)(1)反應Fe(s)+CO2(g) FeO(s)+CO(g) △H1,平衡常數為K1
FeO(s)+CO(g) △H1,平衡常數為K1
反應Fe(s)+H2O(g) FeO(s)+H2(g)
△H2,平衡常數為K2
FeO(s)+H2(g)
△H2,平衡常數為K2
在不同溫度時K1、K2的值如下表:
|
|
700℃ |
900℃ |
|
K1 |
1.47 |
2.15 |
|
K2 |
2.38 |
1.67 |
①反應 CO2(g) + H2(g) CO(g) + H2O(g) △H ,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g)
+ H2(g)
CO(g) + H2O(g) △H ,平衡常數K,則△H= (用△H1和△H2表示),K= (用K1和K2表示),且由上述計算可知,反應CO2(g)
+ H2(g) CO(g) + H2O(g)是
反應(填“吸熱”或“放熱”)。
CO(g) + H2O(g)是
反應(填“吸熱”或“放熱”)。
②能判斷CO2(g)
+ H2(g) CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
CO(g) + H2O(g)達到化學平衡狀態的依據是 (填序號)。
A.容器中壓強不變 B.混合氣體中c(CO)不變
C.v正(H2)= v逆(H2O) D.c(CO)= c(CO2)
(2)一定溫度下,向某密閉容器中加入足量鐵粉并充入一定量的CO2氣體,發生反應Fe(s)+CO2(g) FeO(s)+CO(g)
△H > 0,CO2的濃度與時間的關系如圖所示:
FeO(s)+CO(g)
△H > 0,CO2的濃度與時間的關系如圖所示:
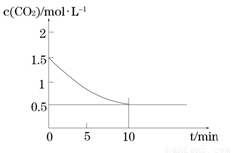
① 該條件下反應的平衡常數為 ;若鐵粉足量,CO2的起始濃度為2.0 mol·L-1,則平衡時CO2的濃度 mol·L-1。
②下列措施中能使平衡時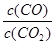 增大的是
(填序號)
增大的是
(填序號)
A.升高溫度 B.增大壓強
C.充入一定量的CO2 D.再加入一定量鐵粉
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com