
| ||
| ||
| ||
| ||
| ||
| ||
| ||
| n |
| V |
| 0.2mol |
| 2L |


科目:高中化學 來源: 題型:
查看答案和解析>>
科目:高中化學 來源:2012-2013學年山東省濟南市高三4月鞏固性訓練理綜化學試卷(解析版) 題型:計算題
硫元素的化合物在生產、生活中有著廣泛的應用。
(1)400℃,1.01× Pa下,容積為1.0L的密閉容器中充入0.5molSO2,
(g)和0.3 molO2 (g),發生反應2SO2(g)+O2(g)
Pa下,容積為1.0L的密閉容器中充入0.5molSO2,
(g)和0.3 molO2 (g),發生反應2SO2(g)+O2(g) 2SO3(g)
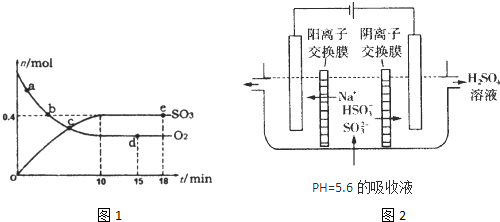
△H=-198kJ/mol。反應中n(SO3)和n(O2)隨時間變化的關系如右圖所示
2SO3(g)
△H=-198kJ/mol。反應中n(SO3)和n(O2)隨時間變化的關系如右圖所示 。反應的平衡常數K=_______;0到10 min內用SO2表示的平均反應速率_________。根據圖中信息,判斷下列敘述中正確的是_____(填序號)。
。反應的平衡常數K=_______;0到10 min內用SO2表示的平均反應速率_________。根據圖中信息,判斷下列敘述中正確的是_____(填序號)。
A.a點時刻的正反應速率比b點時刻的大
B.c點時刻反應達到平衡狀態
C.d點和e點時刻的c(O2)相同
D.若5 00℃,1.01×105Pa下,反應達到平衡時,n( SO3) 比圖中e點時刻的值大
(2)用NaOH溶液吸收工業廢氣中的SO2,當吸收液失去吸收能力時,25℃時測得溶液的pH=5.6,溶液中Na+,H+, HSO3-,SO32-離子的濃度由大到小的順序是__________________。
(3)可通過電解法使(2)中的吸收液再生而循環利用(電極均為石墨電極),其工作示意圖如下:

HSO3-在陽極室反應的電極反應式為________________________,陰極室的產物_________________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com