
 CO(g)+H2(g) ΔH=+131.3 kJ?mol-1,
CO(g)+H2(g) ΔH=+131.3 kJ?mol-1, H2(g)+CO2(g),某溫度下該反應的平衡常數K= 4/9。該溫度下在甲、乙、丙三個恒容密閉容器中,只投入H2(g)和CO2(g),其起始濃度如下表所示。下列判斷不正確的是 。
H2(g)+CO2(g),某溫度下該反應的平衡常數K= 4/9。該溫度下在甲、乙、丙三個恒容密閉容器中,只投入H2(g)和CO2(g),其起始濃度如下表所示。下列判斷不正確的是 。| 起始濃度 | 甲 | 乙 | 丙 |
| c(H2)/mol/L | 0.010 | 0.020 | 0.020 |
| c(CO2)/mol/L | 0.010 | 0.010 | 0.020 |
 CH3OH(g)+H2O(g) ,右圖表示該反應進行過程中能量(單位為kJ?mol—1)的變化。在體積為1 L的恒容密閉容器中,充入1mol CO2和3mol H2反應
CH3OH(g)+H2O(g) ,右圖表示該反應進行過程中能量(單位為kJ?mol—1)的變化。在體積為1 L的恒容密閉容器中,充入1mol CO2和3mol H2反應
 H2O(g)+CO(g)
H2O(g)+CO(g)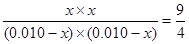 ,解得x=0.006,即轉化率是60%。乙中最大氫氣的濃度,可以提高二氧化碳的轉化率。
,解得x=0.006,即轉化率是60%。乙中最大氫氣的濃度,可以提高二氧化碳的轉化率。

科目:高中化學 來源:不詳 題型:單選題
| A.當溶液中c(CH3COO─)=c(Na+)時,醋酸與氫氧化鈉恰好完全反應 |
| B.當溶液中c(CH3COO─)=c(Na+)時,一定是氫氧化鈉過量 |
| C.當溶液中c(CH3COO─)=c(Na+)>c(H+)=c(OH─)時,一定是醋酸過量 |
| D.當溶液中c(Na+)>c(CH3COO─)>c(OH─)>c(H+)時,一定是氫氧化鈉過量 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.a=b | B.a>b | C.a<b | D.無法確定 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 2NH3 (g) ΔH=-92.4 kJ/mol
2NH3 (g) ΔH=-92.4 kJ/mol  S (g) + 2H2O (g) ΔH =+90.4 kJ/mol
S (g) + 2H2O (g) ΔH =+90.4 kJ/mol CH3OH (g) ΔH=-90.8 kJ/mol
CH3OH (g) ΔH=-90.8 kJ/mol查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.KOH(aq) + 1/2 H2SO4(aq) =1/2K2SO4(aq) + H2O (l);ΔH=-11.46kJ/mol |
| B.2KOH(s) +H2SO4(aq) = K2SO4(aq) + 2H2O (l);ΔH=-114.6kJ/mol |
| C.2KOH(aq) +H2SO4 =K2SO4(aq) + H2O (l) ;ΔH=+114.6kJ/mol |
| D.KOH (aq) + 1/2 H2SO4(aq) =" 1/2" K2SO4(aq) + H2O (l) ;ΔH=-57.0kJ/mol |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.KOH(aq)+1/2H2SO4(aq)==1/2K2SO4(aq)+H2O(l); △H=-11.46 kJ/mol |
| B.2KOH(aq)+ H2SO4(aq)==K2SO4(aq)+2H2O(g);△H=-114.6 kJ/mol |
| C.2KOH(aq)+ H2SO4(aq)==K2SO4(aq)+2H2O(l);△H=+114.6 kJ/mol |
| D.KOH(aq)+1/2H2SO4(aq)==1/2K2SO4(aq)+H2O(l);△H=-57.3 kJ/mol |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
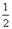 O2(g) △H1 =" +242" kJ·mol-1
O2(g) △H1 =" +242" kJ·mol-1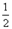 O2(g)="MgO(s) " △H3 = -602kJ·mol-1
O2(g)="MgO(s) " △H3 = -602kJ·mol-1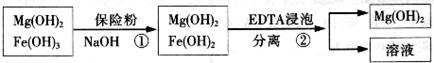
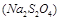 的作用: 。
的作用: 。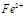 反應生成易溶于水的物質,不與
反應生成易溶于水的物質,不與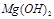 反應。雖然
反應。雖然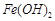 難溶于水,但步驟②中隨著EDTA的加入,最終能夠將
難溶于水,但步驟②中隨著EDTA的加入,最終能夠將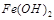 除去并獲得純度高的
除去并獲得純度高的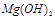 。請從沉淀溶解平衡的角度加以解釋 ;
。請從沉淀溶解平衡的角度加以解釋 ;| 精制阻燃劑的條件 | 阻燃劑鐵含量 | |||
| 序號 | 提純體系溫度/℃ | 加入EDTA質量/g | 加入保險粉質量/g | W(Fe)/(10-4g) |
| 1 | 40 | 0.05 | 0.05 | 7.63 |
| 2 | 40 | 0.05 | 0.10 | 6.83 |
| 3 | 60 | 0.05 | 0.10 | 6.83 |
| 4 | 60 | 0.10 | 0.10 | 6.51 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.Fe3O4 + 4CO =" 3Fe" + 4CO2△H= -14kJ·mol-1 |
| B.Fe3O4(s) + 4CO(g) =" 3Fe(s)" + 4CO2(g)△H= -22kJ·mol-1 |
| C.Fe3O4(s) + 4CO(g) =" 3Fe(s)" + 4CO2(g)△H= +14kJ·mol-1 |
| D.Fe3O4(s) + 4CO(g) =" 3Fe(s)" + 4CO2(g)△H= -14kJ·mol-1 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 0分)汽車尾氣中含有CO、NO2
0分)汽車尾氣中含有CO、NO2 等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化成無毒氣體。
等有毒氣體,對汽車加裝尾氣凈化裝置,可使有毒氣體相互反應轉化成無毒氣體。 (g) ΔH=-393.5 kJ·mol-1
(g) ΔH=-393.5 kJ·mol-1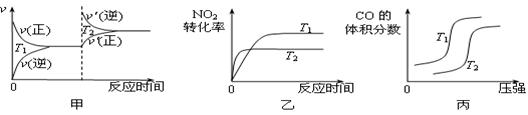 ΔH= ▲ 。對于該反應,溫度不同(T2>T1)、其他條件相同時,下列圖像正確的是 ▲
ΔH= ▲ 。對于該反應,溫度不同(T2>T1)、其他條件相同時,下列圖像正確的是 ▲  (填代號)。
(填代號)。查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com