
【題目】麥考酚酸是一種有效的免疫抑制劑,能有效地防止腎移植排斥,其結構簡式如下圖所示。
下列有關麥考酚酸說法正確的是( )
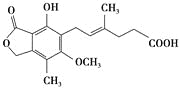
A.在一定條件下可與氫氣發生加成反應,最多消耗氫氣5 mol
B.不能與FeCl3溶液發生顯色反應
C.在一定條件下可發生氧化、還原、取代、消去反應
D.1 mol麥考酚酸最多能與3 mol NaOH反應
 口算題卡北京婦女兒童出版社系列答案
口算題卡北京婦女兒童出版社系列答案科目:高中化學 來源: 題型:
【題目】現有反應:mA(g)+nB(g)![]() pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數也減小,則:
pC(g),達到平衡后,當升高溫度時,B的轉化率變大;當減小壓強時,混合體系中C的質量分數也減小,則:
(1) m+n_________p(填“>”“=”“<”)。
(2)若加壓時,A的質量分數_________。(填“增大”“減小”或“不變”,下同)
(3)若加入A(體積不變),則B的轉化率_________。
(4)若降低溫度,則平衡時B、C的濃度之比![]() 將_________。
將_________。
(5)若加入催化劑,平衡時氣體混合物的總物質的量___________。
(6)若B是有色物質,A、C均無色,維持容器內壓強不變,充入氖氣時,混合物顏色_______(填“變深”“變淺”或“不變”)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】環戊烯是生產精細化工產品的重要中間體,其制備涉及的反應如下:
氫化反應:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (環戊烯)(l) H=-100.5 kJ/mol
(環戊烯)(l) H=-100.5 kJ/mol
副反應:![]() (l)+H2(g)
(l)+H2(g)![]()
![]() (環戊烷)(l) H=-109.4 kJ/mol
(環戊烷)(l) H=-109.4 kJ/mol
解聚反應:
![]() 2
2![]() (g) H>0
(g) H>0
回答下列問題:
(1)反應![]() (l)+2H2(g)
(l)+2H2(g)![]()
![]() (l)的△H=_________ kJ/mol。
(l)的△H=_________ kJ/mol。
(2)一定條件下,將環戊二烯溶于有機溶劑進行氫化反應(不考慮二聚反應),反應過程中保持氫氣壓力不變,測得環戊烯和環戊烷的產率(以環戊二烯為原料計)隨時間變化如圖所示:
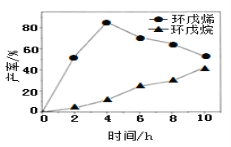
①0~4 h氫化反應速率比副反應快的可能原因是___________________。
②最佳的反應時間為_________h。若需迅速減慢甚至停止反應,可采取的措施有__________________(寫一條即可)。
③一段時間后,環戊烯產率快速下降的原因可能是_____________________。
(3)解聚反應在剛性容器中進行(不考慮氫化反應和副反應)。
①其他條件不變,有利于提高雙環戊二烯平衡轉化率的是________(填標號)。
A.增大雙環戊二烯的用量 B.使用催化劑 C.及時分離產物 D.適當提高溫度
②實際生產中常通入水蒸氣以降低雙環戊二烯的溫度(水蒸氣不參與反應)。某溫度下,通入總壓為300 kPa的雙環戊二烯和水蒸氣,達到平衡后總壓為500 kPa,雙環戊二烯的轉化率為80%,則 p(H2O)=________kPa,平衡常數Kp=__________kPa (Kp為以分壓表示的平衡常數)。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】研究小組設計用含氯的有機物A合成棉織物免燙抗皺整理劑M的路線如下(部分反應試劑和條件未注明):

已知:①E的分子式為C5H8O4,能發生水解反應,核磁共振氫譜顯示E分子內有2種不同化學環境的氫原子,其個數比為3∶1;

(R、R′、R″代表相同或不相同的烴基)。
(1)A分子中的含氧官能團的名稱是________________。
(2)D→E反應的化學方程式是____________。
(3)A→B反應所需的試劑是________________。
(4)G→H反應的化學方程式是____________。
(5)已知1 mol E與2 mol J反應生成1 mol M,則M的結構簡式是________。
(6)E的同分異構體有下列性質:①能與NaHCO3反應生成CO2;②能發生水解反應,且水解產物之一能發生銀鏡反應,則該同分異構體共有________種,其中任意1種的結構簡式是________。
(7)J可合成高分子化合物,該高分子化合物的結構簡式是________。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】PCl3是磷的常見氯化物,可用于半導體生產的外延、擴散工序。有關物質的部分性質如下:
熔點/℃ | 沸點/℃ | 密度/ g·mL-1 | 其他 | |
黃磷 | 44.1 | 280.5 | 1.82 | 2P+3Cl2(少量) |
PCl3 | -112 | 75.5 | 1.574 | 遇水生成H3PO3和HCl,遇O2生成POCl3 |
(一)制備
如圖是實驗室制備PCl3的裝置(部分儀器已省略)。

(1)儀器乙的名稱是________;其中,與自來水進水管連接的接口編號是________。(填“a”或“b”)
(2)實驗室制備Cl2的離子方程式___________________________。實驗過程中,為減少PCl5的生成,應控制____________。
(3)堿石灰的作用:一是防止空氣中的水蒸氣進入而使PCl3水解,影響產品的純度;二是_________。
(4)向儀器甲中通入干燥Cl2之前,應先通入一段時間CO2排盡裝置中的空氣,其目的是________。
(二)分析
測定產品中PCl3純度的方法如下:迅速稱取4.100 g產品,水解完全后配成500 mL溶液,取出25.00 mL加入過量的0.100 0 mol·L-1 20.00 mL碘溶液,充分反應后再用0.100 0 mol·L-1 Na2S2O3溶液滴定過量的碘,終點時消耗12.00 mL Na2S2O3溶液。
已知:H3PO3+H2O+I2===H3PO4+2HI;I2+2Na2S2O3===2NaI+Na2S4O6;假設測定過程中沒有其他反應。
(5)根據上述數據,該產品中PCl3(相對分子質量為137.5)的質量分數為________。若滴定終點時俯視讀數,則PCl3的質量分數________(填“偏大”“偏小”或“無影響”)。
(三)探究
(6)設計實驗證明PCl3具有還原性:_____________________________________。(限選試劑有:蒸餾水、稀鹽酸、碘水、淀粉)
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】化合物X是一種環境激素,存在如圖轉化關系:
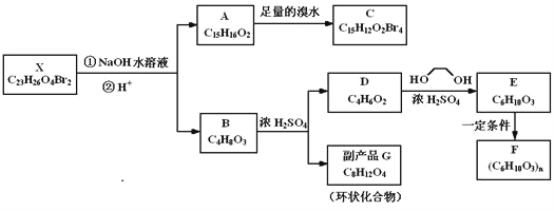
化合物A能與FeCl3溶液發生顯色反應,分子中含有兩個化學環境完全相同的甲基,其苯環上的一硝基取代物只有兩種。1H﹣NMR譜顯示化合物G的所有氫原子化學環境相同。F是一種可用于制備隱形眼鏡的高聚物。根據以上信息回答下列問題:
(1)下列敘述正確的是__;
a.化合物A分子中含有聯苯結構單元
b.化合物A可以和NaHCO3溶液反應,放出CO2氣體
c.X與NaOH溶液反應,理論上1mol X最多消耗6mol NaOH
d.化合物D能與Br2發生加成反應
(2)化合物C的結構簡式是__,A→C的反應類型是__;
(3)寫出同時滿足下列條件的D的所有同分異構體的結構簡式(不考慮立體異構)__;
a.屬于酯類 b.能發生銀鏡反應
(4)寫出B→G反應的化學方程式__;
(5)寫出E→F反應的化學方程式__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】“麻黃素”是中樞神經興奮劑,其合成路線如圖所示:
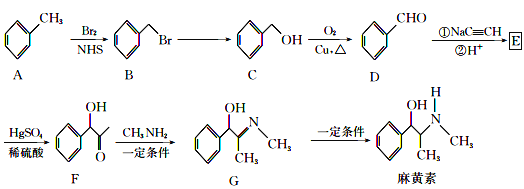
已知:CH3C![]() CH+H2O
CH+H2O![]()
(1)F中的官能團的名稱為__。
(2)B→C的反應條件是__,反應類型是__,E的結構簡式為__。
(3)寫出C→D的化學反應方程式__。
(4)麻黃素的分子式為__。
(5)H是G的同系物,也含醇羥基和碳氮雙鍵,相對分子質量比G小28,且苯環上僅有一個側鏈,則H的可能結構有___種(不考慮![]() 結構)。
結構)。
(6)已知:R-C![]() C-R
C-R![]() R-CH=CH-R,請仿照題中流程圖合成路線,設計以乙醇為起始主原料合成強吸水性樹脂
R-CH=CH-R,請仿照題中流程圖合成路線,設計以乙醇為起始主原料合成強吸水性樹脂![]() 的合成路線,其它試劑及溶劑任選__。
的合成路線,其它試劑及溶劑任選__。
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】室溫下,將pH=12的NaOH溶液平均分成兩份,一份加水V1 L,另一份加入與該NaOH溶液物質的量濃度相等的硫酸V2 L,pH都降低了1,則V1 :V2 為(溶液體積可以疊加)
A. 10 : 1 B. 11 : 1 C. 20 : 1 D. 21 : 1
查看答案和解析>>
科目:高中化學 來源: 題型:
【題目】向硝酸酸化的2 mL 0.1 mol·L-1 AgNO3溶液(pH=2)中加入過量鐵粉,振蕩后靜置,溶液先呈淺綠色,后逐漸呈棕黃色,試管底部仍存在黑色固體,過程中無氣體生成。實驗小組同學針對該實驗現象進行了如下探究。
Ⅰ.探究Fe2+產生的原因。
(1)提出猜想:Fe2+可能是Fe與________或________反應的產物。(均填化學式)
(2)實驗探究:在兩支試管中分別加入與上述實驗等量的鐵粉,再加入不同的液體試劑,5 min后取上層清液,分別加入相同體積和濃度的鐵氰化鉀溶液。
液體試劑 | 加入鐵氰化 | |
鉀溶液 | ||
1號試管 | 2 mL 0.1 mol·L-1 | |
AgNO3溶液 | 無藍色沉淀 | |
2號試管 | 硝酸酸化的2 mL 0.1 mol·L-1______溶液(pH=2) | 藍色沉淀 |
①2號試管中所用的試劑為_________。
②資料顯示:該溫度下,0.1 mol·L-1 AgNO3溶液可以將Fe氧化為Fe2+。但1號試管中未觀察到藍色沉淀的原因可能為_______。
③小組同學繼續進行實驗,證明了由2號試管得出的結論正確。實驗如下:取100 mL 0.1 mol·L-1硝酸酸化的AgNO3溶液(pH=2),加入鐵粉并攪拌,分別插入pH傳感器和NO![]() 傳感器(傳感器可檢測離子濃度),得到圖甲、圖乙,其中pH傳感器測得的圖示為________(填“圖甲”或“圖乙”)。
傳感器(傳感器可檢測離子濃度),得到圖甲、圖乙,其中pH傳感器測得的圖示為________(填“圖甲”或“圖乙”)。
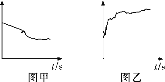
④實驗測得2號試管中有NH4+生成,則2號試管中發生反應的離子方程式為__________。
Ⅱ.探究Fe3+產生的原因。
查閱資料可知,反應中溶液逐漸變棕黃色是因為Fe2+被Ag+氧化了。小組同學設計了不同的實驗方案對此進行驗證。
(3)方案一:取出少量黑色固體,洗滌后,______(填操作和現象),證明黑色固體中有Ag。
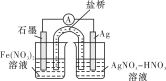
(4)方案二:按下圖連接裝置,一段時間后取出左側燒杯中的溶液,加入KSCN溶液,溶液變紅。該實驗現象________(填“能”或“不能”)證明Fe2+可被Ag+氧化,理由為________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com