
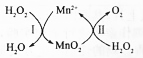
 MnSO4可用作催化劑和生產微量元素肥料等,回答下列問題:
MnSO4可用作催化劑和生產微量元素肥料等,回答下列問題:分析 (1)在軟錳礦懸濁液中主要是MnO2,具有氧化性,通入二氧化硫氣體具有還原性,酸性溶液中二氧化錳做氧化劑,化合價降低生成硫酸錳,能氧化二氧化硫,硫元素化合價升高為+6價生成產物為硫酸;
(2)在上述濾液(含有Mn2+、Fe2+等離子)中滴加Na2S溶液,當MnS開始沉淀時,依據溶度積常數分析,亞鐵離子全部沉淀后才開始析出MnS,依據沉淀共存和溶度積常數計算離子濃度比值;
(3)轉化關系可知,過氧化氫和錳離子反應得到二氧化錳和氫離子,依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式.
解答 解:(1)在軟錳礦懸濁液中主要是MnO2,具有氧化性,通入二氧化硫氣體具有還原性,酸性溶液中二氧化錳做氧化劑,化合價降低生成硫酸錳,能氧化二氧化硫,硫元素化合價升高為+6價生成產物為硫酸,則二氧化硫的氧化產物為H2SO4,
故答案為:H2SO4;
(2)在上述濾液(含有Mn2+、Fe2+等離子)中滴加Na2S溶液,當MnS開始沉淀時,依據溶度積常數分析,亞鐵離子全部沉淀后才開始析出MnS,依據沉淀共存和溶度積常數計算離子濃度比值,FeS+Mn2+=MnS+Fe2+,K=$\frac{c(F{e}^{2+})}{c(M{n}^{2+})}$=$\frac{c(F{e}^{2+})}{c(M{n}^{2+})}$×$\frac{c({S}^{2-})}{c({S}^{2-})}$=$\frac{Ksp(FeS)}{Ksp(MnS)}$=$\frac{7.0×1{0}^{-18}}{1.4×1{0}^{-15}}$=5×10-3,
故答案為:5×10-3;
(3)轉化關系可知,過氧化氫和錳離子反應得到二氧化錳和氫離子,
2H2O2(l)═2H2O(l)+O2(g)△H1①,
MnO2(s)+H2O2(l)+2H+═Mn2+(aq)+O2(g)+2H2O(l)△H2,②
依據蓋斯定律①-②得到H2O2(l)+Mn2+(aq)═MnO2(s)+2H+(aq)△H=△H1-△H2
故答案為:H2O2(l)+Mn2+(aq)═MnO2(s)+2H+(aq)△H=△H1-△H2.
點評 本題考查了氧化還原反應,蓋斯定律和熱化學方程式計算,沉淀溶解平衡和溶度積常數的計算應用,題目難度中等.


 全優考典單元檢測卷及歸類總復習系列答案
全優考典單元檢測卷及歸類總復習系列答案 品學雙優卷系列答案
品學雙優卷系列答案 小學期末沖刺100分系列答案
小學期末沖刺100分系列答案科目:高中化學 來源: 題型:選擇題
| A. | Cl2和澄清石灰水反應:Cl2+2OH-═Cl-+ClO-+H2O | |
| B. | NaHCO3溶液與NaOH溶液反應:OH-+HCO3-═CO2↑+H2O | |
| C. | 向AlCl3溶液中加入過量的氨水:Al3++3OH-═Al(OH)3↓ | |
| D. | 實驗室用大理石和稀醋酸制取CO2:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 .
.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. |  | B. |  | ||
| C. |  | D. |  |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
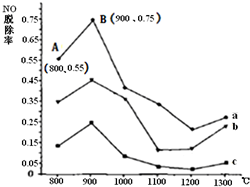 尿素[CO(NH2)2]在一定條件下能有效將NO轉化為N2.如圖為CO(NH2)2與某種煙氣(主要為N2、NO)中NO的物質的量比值分別為1:2、2:1、3:1時,NO脫除率(NO的消耗量與NO的原始量的比值)隨溫度變化的曲線圖.
尿素[CO(NH2)2]在一定條件下能有效將NO轉化為N2.如圖為CO(NH2)2與某種煙氣(主要為N2、NO)中NO的物質的量比值分別為1:2、2:1、3:1時,NO脫除率(NO的消耗量與NO的原始量的比值)隨溫度變化的曲線圖.查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 在空氣中切開金屬鈉,光亮表面變暗:2Na+O2═Na2O2 | |
| B. | 向氯化鋁溶液中加入過量氨水,產生白色沉淀:Al3++3OH-═Al(OH)3↓ | |
| C. | 將鐵粉與水蒸氣共熱,產生氣體:2Fe+3H2O(g)$\frac{\underline{\;\;△\;\;}}{\;}$Fe2O3+3H2 | |
| D. | 鈉投入到水中,產生氣體:2Na+2H2O═2NaOH+H2↑ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com