
| A. | 鎂和銀 | B. | 鐵和鋅 | C. | 鋁和鐵 | D. | 鎂和鐵 |
分析 假設金屬都為+2價,金屬總物質的量等于氫氣物質的量,根據M=$\frac{m}{n}$計算金屬混合物的平均相對原子質量,故平均相對原子質量應介于各組分之間,根據電子轉移守恒,若金屬不與鹽酸反應,其相對原子質量可以視作無窮大,若Al為+2價時,其相對原子質量為27×$\frac{2}{3}$=18.
解答 解:標況下11.2L氫氣物質的量為:$\frac{11.2L}{22.4L/mol}$=0.5mol,假設金屬均為+2價,金屬總物質的量等于氫氣物質的量,故混合金屬平均相對分子質量為$\frac{15}{0.5}$=30,因為為兩種金屬的混合物,故平均相對分子質量應介于各組分之間.
A.Mg的相對原子質量為24,Ag與鹽酸不反應,其相對原子質量視作無窮大,符合題意,故A正確;
B.Fe的相對原子質量為56,Zn的相對分子質量為65,平均值大于30,不符合題意,故B錯誤;
C.若Al為+2價時,其相對原子質量為27×$\frac{2}{3}$=18,Fe的相對原子質量為56,符合題意,故C正確;
D.Mg的相對原子質量為24,Fe的相對原子質量為56,平均值可能為30,故D正確;
故選B.
點評 本題考查混合物的計算,難度中等,注意利用平均值法析解答,側重考查學生分析計算能力,注意化合價與相對原子質量的關系.


 亮點激活精編提優100分大試卷系列答案
亮點激活精編提優100分大試卷系列答案科目:高中化學 來源: 題型:選擇題
| A. | 某溶液加入幾滴KSCN溶液后不變色再滴加幾滴氯水后,溶液變紅,說明該溶液一定有Fe2+ | |
| B. | 某溶液滴加AgNO3溶液產生白色沉淀,說明該溶液一定含Cl- | |
| C. | 某溶液加入稀鹽酸產生無色無味氣體,將氣體通入澄清石灰水中,溶液變渾濁,說明該溶液一定有CO32- | |
| D. | 某溶液滴加鹽酸酸化的BaCl2溶液后,有白色沉淀產生,說明該溶液一定含SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
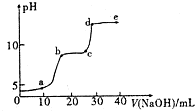 某研究性學習小組擬探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液時,生成氫氧化物沉淀的過程.
某研究性學習小組擬探究在含Mg2+、Al3+的混合溶液中滴加NaOH溶液時,生成氫氧化物沉淀的過程.| 較大量存在的含金屬元素的離子 | 檢驗方法 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液只能由等物質的量濃度、等體積的氫氧化鈉溶液和醋酸溶液混合而成 | |
| B. | 該溶液一定由pH=3的醋酸溶液與pH=11的氫氧化鈉溶液等體積混合而成 | |
| C. | 該溶液中離子濃度一定為c(Na+)>c(CH3COO-)>c(OH-)>c(H+) | |
| D. | 加入一定冰醋酸,c(CH3COO-)可能大于、等于或小于c(Na+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| n(SO32-):n(HSO3-) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
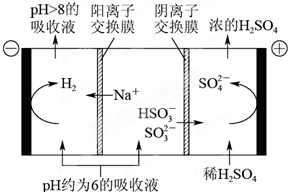
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
| ① | A1 | B1 | C1 | D1 |
| 電子數 | 10 | 10 | 10 | 18 |
| ② | A2 | B2 | C2 | D2 |
| 電子數 | 10 | 10 | 10 | 18 |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題
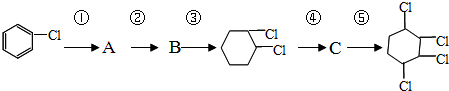
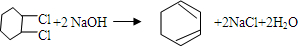 、⑤
、⑤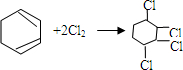 .
.查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com