
幾種短周期元素的原子半徑及主要化合價如下表:
元素代號 | L | M | X | R | T |
原子半徑/nm | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 |
主要化合價 | +2 | +3 | +6,-2 | +2 | -2 |
下列敘述正確的是( )
A.離子半徑大小:r(M3+)>r(T2-)
B.R的氧化物對應的水化物可能具有兩性
C.X單質在氧氣中燃燒生成XO3
D.L、X形成的簡單離子核外電子數相等
科目:高中化學 來源:2016-2017學年遼寧省分校高二上期中化學卷(解析版) 題型:選擇題
如下圖所示,下列說法正確的是( )
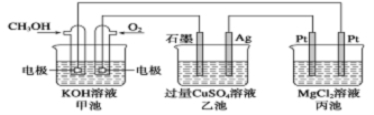
A.甲池是電能轉化為化學能的裝置,乙、丙池是化學能轉化電能的裝置
B.甲池通入CH3OH的電極反應式為CH3OH-6e-+2H2O===CO32-+8H+
C.反應一段時間后,向乙池中加入一定量Cu(OH)2固體能使CuSO4溶液恢復到原濃度
D.甲池中消耗280 mL(標準狀況下)O2,此時丙池中理論上最多產生14. 5 g固體
查看答案和解析>>
科目:高中化學 來源:2017屆遼寧省大連市高三12月月考化學試卷(解析版) 題型:選擇題
25℃時,將氨水與氯化銨溶液混合得到c(NH3·H2O)+c(NH4+)=0.1 mol·L-1的混合溶液。溶液中c(NH3·H2O)、c(NH4+)與pH的關系如圖所示。下列有關離子濃度關系敘述一定正確的是( ) 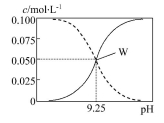
A.W點表示溶液中:c(NH4+)+c(H+)=c(OH-)
B.pH=10.5溶液中:c(Cl-)+c(OH-)+c(NH3·H2O)<0.1 mol·L-1
C.pH=9.5溶液中:c(NH3·H2O)>c(NH4+)>c(OH-)>c(H+)
D.向W點所表示的1 L溶液中加入0.05 mol NaOH固體(忽略溶液體積變化):c(Cl-)>c(Na+)>c(OH-)>c(N H4+)>c(H+)
查看答案和解析>>
科目:高中化學 來源:2017屆江西省等四校高三上聯考一化學試卷(解析版) 題型:選擇題
下列有關化學用語表示正確的是
A.中子數為10的氧原子: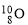
 B.Mg2+的結構示意圖:
B.Mg2+的結構示意圖: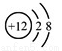
C.硫化鈉的電子式: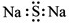 D.甲酸甲酯的結構簡式:C2H4O2
D.甲酸甲酯的結構簡式:C2H4O2
查看答案和解析>>
科目:高中化學 來源:2017屆江西省贛州市十三縣(市)高三上期中化學試卷(解析版) 題型:選擇題
有一稀硫酸和稀硝酸的混合酸,其中H2SO4和HNO3的物質的量濃度分別是4mol/L和2mol/L,取10mL此混合酸,向其中加入過量的鐵粉,待反應結束后,可產生標準狀況下的氣體的體積為(設反應中HNO3被還原成NO)( )
A. 0.448 L B.0.896 L C.0.672 L D. 0.224L
查看答案和解析>>
科目:高中化學 來源:2017屆江西省贛州市十三縣(市)高三上期中化學試卷(解析版) 題型:選擇題
下列陳述均正確且Ⅰ、Ⅱ兩者間有因果關系的是( )
選項 | 陳述Ⅰ | 陳述Ⅱ |
A | 工業合成氨的反應在高溫下進行 | N2+3H2 |
B | 明礬水溶液水解生成膠體 | 明礬可用于凈水 |
C | SiO2是酸性氧化物 | HF溶液不能用玻璃試劑瓶盛放 |
D | 氯的非金屬性比碘強 | 酸性:氫碘酸強于鹽酸 |
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高一上月考三化學試卷(解析版) 題型:實驗題
 利用如圖裝置測定中和熱的實驗步驟如下:
利用如圖裝置測定中和熱的實驗步驟如下:
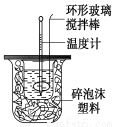
①用量筒量取50 mL 0.25 mol/L硫酸倒入小燒杯中,測出硫酸溫度;
②用另一量筒量取50 mL 0.55 mol/L NaOH溶 液,并用另一溫度計測出其溫度;
液,并用另一溫度計測出其溫度;
③將NaOH溶液倒入小燒杯中,設法使之混合均勻,測出混合液最高溫度。
回答下列問題:
(1)寫出稀硫酸和稀氫氧化鈉溶液反應,表示中和熱的熱化學方程式(中和熱數值為57.3 kJ/mol)
kJ/mol)  。
。
(2)倒入 NaOH溶液的正確操作是 (從下列選出)。
NaOH溶液的正確操作是 (從下列選出)。
A.沿玻璃棒緩慢倒入 B.分三次少量倒入 C.一次迅速倒入
(3)使硫酸與NaOH溶液混合均勻的正確操作是 (從下列選出)。
A.用溫度計小心攪拌 B.揭開硬紙片用玻璃棒攪拌
C.輕輕地振蕩燒杯 D.用套在溫度計上的環形玻璃棒攪拌棒輕輕地攪動
(4)實驗數據如下表:
①請填寫下表中的溫度差平均值:
溫度 實驗次數 | 起始溫度 t1/℃ | 終止溫度t2/℃ | 溫度差平均值(t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 29.5 | |
2 | 25.9 | 25.9 | 25.9 | 29.2 | |
3 | 26.4 | 26.2 | 26.3 | 29.8 | |
②近似認為0.55 mol/L NaOH溶液和0.25 mol/L硫酸溶液的密度都是1 g/cm3,中和后生成溶液的比熱容c=4.18 J/(g·℃),則 中和熱ΔH= (取小數點后一位)。
中和熱ΔH= (取小數點后一位)。
③上述實驗數值結果與57.3 kJ/mol有偏差,產生偏差的原因可能是(填字母) 。
a.實驗裝置保溫、隔熱效果差
b.量取NaOH溶液的體積時平視讀數
c.分多次把NaOH溶液倒入盛 有硫酸的小燒杯中
有硫酸的小燒杯中
d.用溫度計測定NaOH溶液起始溫度后,用另一支溫度計測定H 2SO4溶液的溫度
2SO4溶液的溫度
查看答案和解析>>
科目:高中化學 來源:2016-2017學年湖南省高一上月考三化學試卷(解析版) 題型:選擇題
在一定溫度下,可逆反應 A(g) + 3B(g)  2C(g) 達到平衡的標志是
2C(g) 達到平衡的標志是
A.單位時間內生成n mol A,同 時生成3n molB
時生成3n molB
B.單位時間內生成3nmolC,同時生成2nmolB
C.A、B、C的濃度相等
D.A、B、C的分子數比為1:3:2[
查看答案和解析>>
科目:高中化學 來源:2016-2017學年河北武邑中學高二上12.4周考化學卷(解析版) 題型:填空題
下列物質①HCl②CO2③H2O④H2⑤NaHSO4⑥Cl2⑦NaF⑧CH4⑨CaO⑩MgCl2
(1)屬于離子化合物的是_______,只含共價鍵的是______,既含有離子鍵又有共價鍵的是______。
(2)屬于電解質的是__________,屬于非電解質的是___________。
(3)將NaHSO4熔化,破壞了NaHSO4中的__________鍵,寫出其電離方程式_____________。將NaHSO4溶于水,破壞了NaHSO4中的_________鍵,寫出其電離方程式_____________。
(4)分別用電子式表示氯化鎂、氯氣的形成過程:____________。
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com