
| A. | 71g氯氣通入足量水中,反應生成的HClO分子數為NA | |
| B. | 1mol硝基與NA個二氧化氮氣體分子所含電子數相等 | |
| C. | 在反應2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,每生成1molO2該反應共轉移的電子數為6NA | |
| D. | 1L 1mol/LAlCl3溶液中所含陽離子數小于NA |
分析 A、氯氣和水的反應為可逆反應;
B、硝基-NO2不帶電荷;
C、反應2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,轉移10mol電子時生成1mol氧氣;
D、Al3+的水解導致溶液中的陽離子的個數增多.
解答 解:A、氯氣和水的反應為可逆反應,不能進行徹底,故生成的次氯酸分子個數小于NA個,故A錯誤;
B、硝基-NO2不帶電荷,故1mol硝基和NA個二氧化氮分子中均含23mol電子,故B正確;
C、反應2FeSO4+6Na2O2=2Na2FeO4+2Na2O+2Na2SO4+O2中,轉移10mol電子時生成1mol氧氣,即當生成1mol氧氣時轉移10mol電子即10NA個,故C錯誤;
D、Al3+的水解導致溶液中的陽離子的個數增多,故溶液中的陽離子的個數大于NA個,故D錯誤.
故選B.
點評 本題考查了阿伏伽德羅常數的有關計算,熟練掌握公式的使用和物質的結構是解題關鍵,難度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小學生10分鐘應用題系列答案
小學生10分鐘應用題系列答案科目:高中化學 來源: 題型:填空題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
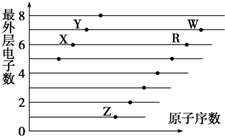
| A. | X和R在同一主族 | |
| B. | 含氧酸酸性:W>R | |
| C. | X與W可以形成酸性氧化物 | |
| D. | X、Z形成的化合物中可能含有共價鍵 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 0.03mol•L-1•s-1 | B. | 0.015mol•L-1•s-1 | ||
| C. | 0.12mol•L-1•s-1 | D. | 0.06mol•L-1•s-1 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
 如圖為一定量飽和 Ca(OH)2溶液中通入二氧化碳氣體后,產生 CaCO3 白色沉淀的質量與二氧化碳體積之間的關系曲線.
如圖為一定量飽和 Ca(OH)2溶液中通入二氧化碳氣體后,產生 CaCO3 白色沉淀的質量與二氧化碳體積之間的關系曲線.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | H+、Ca2+、NO3-、CO32- | B. | Fe3+、K+、OH-、SO42- | ||
| C. | Ag+、Na+、Cl-、K+ | D. | K+、Na+、Cl-、NO3- |
查看答案和解析>>
科目:高中化學 來源: 題型:填空題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com