
 2C(g) △H>O,其他條件不變,只有溫度改變時,某量隨溫度變化的關系如圖所示。則下列說法正確的是
2C(g) △H>O,其他條件不變,只有溫度改變時,某量隨溫度變化的關系如圖所示。則下列說法正確的是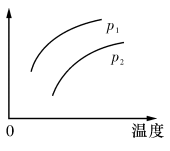
| A.P1>P2,縱坐標可表示A的質量分數(shù) |
| B.P1 <P2,縱坐標可表示C的質量貧數(shù) |
| C.P1>P2,縱坐標可表示混合氣體的平均摩爾質量 |
| D.P1<P2,縱坐標可表示A的轉化率 |
科目:高中化學 來源:不詳 題型:單選題
| A.強電解質溶液的導電能力一定比弱電解質溶液的強 |
B.一定溫度下,可逆反應2X (g)+Y (g)  2Z (g)達到平衡的標志是:容器內X、Y、Z的物質的量之比為2:1:2 2Z (g)達到平衡的標志是:容器內X、Y、Z的物質的量之比為2:1:2 |
| C.升高溫度,AgCl的溶解度增大,Ksp增大 |
| D.FeCl3、KAl(SO4)2、Na2CO3的水溶液均顯酸性 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.在平衡常數(shù)表達式中,反應物濃度用起始濃度表示,生成物濃度用平衡濃度表示 |
| B.化學平衡常數(shù)較大的可逆反應,所有反應物的轉化率一定大 |
| C.可以用化學平衡常數(shù)來定量描述化學反應的限度 |
| D.平衡常數(shù)的大小與溫度、濃度、壓強、催化劑有關 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.當有1 mol N≡N鍵斷裂的同時,有3 mol H—H鍵斷裂 |
| B.當有1 mol N≡N鍵斷裂的同時,有6 mol N—H鍵形成 |
| C.當有1 mol N≡N鍵斷裂的同時,有6 mol H—H鍵形成 |
| D.當有1 mol N≡N鍵斷裂的同時,有6 mol N—H鍵斷裂 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
 TaI4(g)+S2(g) ΔH>0(I)
TaI4(g)+S2(g) ΔH>0(I)
 HSO3-+H+的電離常數(shù)Ka=1×10-2mol·L-1,則該溫度下NaHSO3水解反應的平衡常數(shù)Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,則溶液中
HSO3-+H+的電離常數(shù)Ka=1×10-2mol·L-1,則該溫度下NaHSO3水解反應的平衡常數(shù)Kh=________mol·L-1,若向NaHSO3溶液中加入少量的I2,則溶液中 將________(填“增大”“減小”或“不變”)。
將________(填“增大”“減小”或“不變”)。查看答案和解析>>
科目:高中化學 來源:不詳 題型:填空題
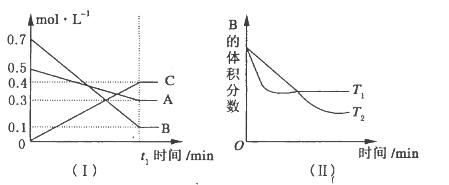
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
| A.平衡常數(shù)的大小與溫度、濃度、壓強、催化劑等有關 |
| B.當溫度升高時,弱酸的電離平衡常數(shù)Ka變小 |
| C.Ksp(AgCl)>Ksp(AgI) ,由此可以判斷AgCl(s) + I-(aq)=AgI(s)+ Cl-(aq)能夠發(fā)生 |
| D.Ka(HCN)<Ka(CH3COOH) ,說明物質的量濃度相同時,氫氰酸的酸性比醋酸強 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 2G(g)。忽略固體體積,平衡時G的體積分數(shù)(%)隨溫度和壓強的變化如下表所示:
2G(g)。忽略固體體積,平衡時G的體積分數(shù)(%)隨溫度和壓強的變化如下表所示:| 壓強/MPa 體積分數(shù)/% 溫度/℃ | 1.0 | 2.0 | 3.0 |
| 810 | 54.0 | a | b |
| 915 | c | 75.0 | d |
| 1 000 | e | f | 83.0 |
查看答案和解析>>
科目:高中化學 來源:不詳 題型:單選題
 p C(g)+q D(g)的反應中,經5 min達到平衡,測得A增加3 mol·L-1,B增加1 mol·L-1,C減少2 mol·L-1,此時若給體系加壓,平衡不移動,則m∶n∶p∶q為( )
p C(g)+q D(g)的反應中,經5 min達到平衡,測得A增加3 mol·L-1,B增加1 mol·L-1,C減少2 mol·L-1,此時若給體系加壓,平衡不移動,則m∶n∶p∶q為( )| A.2∶3∶2∶3 | B.2∶2∶3∶3 |
| C.3∶1∶2∶2 | D.3∶1∶2∶3 |
查看答案和解析>>
湖北省互聯(lián)網違法和不良信息舉報平臺 | 網上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com