
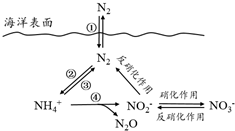
 氮元素在海洋中的循環(huán),是整個海洋生態(tài)系統(tǒng)的基礎和關(guān)鍵.海洋中無機氮的循環(huán)過程可用如圖表示.
氮元素在海洋中的循環(huán),是整個海洋生態(tài)系統(tǒng)的基礎和關(guān)鍵.海洋中無機氮的循環(huán)過程可用如圖表示.| 溫度/℃ | 樣本氨氮含量/mg | 處理24h | 處理48h |
| 氨氮含量/mg | 氨氮含量/mg | ||
| 20 | 1008 | 838 | 788 |
| 25 | 1008 | 757 | 468 |
| 30 | 1008 | 798 | 600 |
| 40 | 1008 | 977 | 910 |
分析 (1)氮的固定作用是指游離態(tài)氮元素發(fā)生反應生成化合態(tài)氮元素的過程為固氮作用,即單質(zhì)變化為化合物;
(2)a.海洋中不存在游離態(tài)的氮,氮元素是以化合態(tài)存在;
b.轉(zhuǎn)化關(guān)系圖可知海洋中的氮循環(huán)起始于氮的氧化;
c.反硝化作用是指將硝酸鹽轉(zhuǎn)變成氮氣的過程.硝化作用是指氨在微生物作用下氧化為硝酸的過程.硝化細菌將氨氧化為硝酸的過程.反硝化作用:反硝化細菌在缺氧條件下,還原硝酸鹽,釋放出分子態(tài)氮(N2)或一氧化二氮(N2O)的過程;
d.轉(zhuǎn)化關(guān)系圖中硝酸根離子增多,反硝化作用增強;
(3)有氧時,在硝化細菌作用下,NH4+可實現(xiàn)過程④的轉(zhuǎn)化,生成N2O、NO2-、H+和水,結(jié)合電荷守恒和原子守恒配平書寫離子方程式得到;
(4)硝化細菌去除氨氮的最佳反應溫度是處理24h和處理48h后氨氮含量最少的處理效果好,速率是單位時間內(nèi)氨氮質(zhì)量的變化計算;
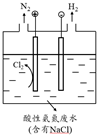
(5)①裝置圖分析可知和電源正極相連的為陽極,溶液中氯離子在陽極失電子生成氯氣,氯氣具有強氧化性酸性溶液中能氧化銨根離子為氮氣除去;
②結(jié)合電解池中的電極反應和生成H2和N2的物質(zhì)的量之比為3:1,依據(jù)電極反應中電子守恒計算溶液中氫離子濃度減小和氫離子濃度增加,判斷溶液PH變化;
解答 解:(1)氮的固定作用是指游離態(tài)氮元素發(fā)生反應生成化合態(tài)氮元素的過程為固氮作用,即單質(zhì)變化為化合物,分析轉(zhuǎn)化關(guān)系圖可知只有反應②是氮氣保護為銨根離子是固氮作用,
故答案為:②;
(2)a.海洋中不存在游離態(tài)的氮,氮元素是以化合態(tài)存在,主要是硝酸根離子,故a錯誤;
b.轉(zhuǎn)化關(guān)系圖可知海洋中的氮循環(huán)起始于氮的氧化,大氣氧化生成氧化物,反應得到銨根離子最后通過硝化作用得到硝酸根離子,故b正確;
c.反硝化作用是指將硝酸鹽轉(zhuǎn)變成氮氣的過程.硝化作用是指氨在微生物作用下氧化為硝酸的過程.硝化細菌將氨氧化為硝酸的過程.反硝化作用:反硝化細菌在缺氧條件下,還原硝酸鹽,釋放出分子態(tài)氮(N2)或一氧化二氮(N2O)的過程,不一定有氧參加,故c錯誤;
d.轉(zhuǎn)化關(guān)系圖中硝酸根離子增多,反硝化作用增強,向海洋排放含NO3-的廢水會影響海洋中NH4+的含量,故d正確;
故答案為:ad;
(3)有氧時,在硝化細菌作用下,NH4+可實現(xiàn)過程④的轉(zhuǎn)化,生成N2O、NO2-、H+和水,氮元素化合價-3價變化為+1價和+3價,氧元素化合價0價變化為-2價,電子轉(zhuǎn)移總數(shù)20e-,所以銨根離子前為4,氧氣前為5,NO2-前為2,N2O前為1,結(jié)合電荷守恒得到氫離子前為6,水分子式前為5,配平得到離子方程式為:4NH4++5O2═2NO2-+6H++N2O+5H2O,
故答案為:6,N2O,5H2O;
(4)硝化細菌去除氨氮的最佳反應溫度是處理24h和處理48h后氨氮含量最少的溫度是25°C,處理效果好,在最佳反應溫度時,48h內(nèi)去除氨氮反應的平均速率=$\frac{\frac{1008mg-468mg}{10L}}{48h}$=1.125mg/(L•h)
故答案為:25℃,1.125;
(5)①裝置圖分析可知和電源正極相連的為陽極,溶液中氯離子在陽極失電子生成氯氣,電極反應為:2Cl--2e-=Cl2 ↑,氯氣具有強氧化性酸性溶液中能氧化銨根離子為氮氣除去,
故答案為:陽極反應2Cl--2e-=Cl2,產(chǎn)生的Cl2氧化廢水中的NH4+釋放出N2;
②電解池中陽極電極反應是:2Cl--2e-=Cl2↑,3Cl2+2NH4+=N2+8H++6Cl-,陰極電極反應為:2H++2e-=H2↑,若生成n (H2):n (N2)=3:1,電子守恒得到6H+~3H2~6e-~N2~3Cl2~6e-~8H+,陽極產(chǎn)生的H+比陰極消耗的H+多,ry PH減小,
故答案為:減小,理由:電路中通過相同電量時,若生成n (H2):n (N2)=3:1,則陽極產(chǎn)生的H+比陰極消耗的H+多;
點評 本題考查了含氮元素的物質(zhì)的綜合應用,原電池和電解池原理的分析,注意數(shù)據(jù)處理方法和轉(zhuǎn)化圖中的信息應用,題目難度較大.


 暑假作業(yè)暑假快樂練西安出版社系列答案
暑假作業(yè)暑假快樂練西安出版社系列答案科目:高中化學 來源: 題型:解答題
 電池的發(fā)明和應用是化學家們對人類社會的重要貢獻之一.
電池的發(fā)明和應用是化學家們對人類社會的重要貢獻之一.查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| /min | 0 | 2 | 4 | 6 |
| n(Cl2)/10-3 mol | 0 | 1.8 | 3.7 | 5.4 |
| A.0~2min的反應速率小于4~6min的反應速率 |
| B.2~6min用Cl2表示的反應速率為0.9mol/(L•min) |
| C.增大壓強可以提高HCl轉(zhuǎn)化率 |
| D.平衡常數(shù)K(200℃)<K(400℃) |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Na暴露于空氣中最終生成Na2O2 | |
| B. | 銅粉能溶于酸性硝酸鈉溶解 | |
| C. | Fe比Al更易與NaOH溶液反應生成H2 | |
| D. | 水蒸氣通過灼熱的鐵粉會有紅棕色固體生成 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A | B | C | D | |
| 方案 |  | 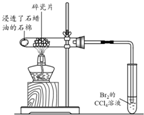 |  | 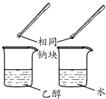 |
| 目的 | 利用乙醇的消去反應制取乙烯 | 驗證石蠟油分解的產(chǎn)物是乙烯 | 檢驗乙烯、乙炔混合氣中的乙烯 | 比較乙醇中羥基氫原子和水分子中氫原子的活潑性 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 無色溶液中 Mg2+、Al3+、SO42-、CO32- | |
| B. | pH=1的溶液中 NH4+、Ba2+、HCO3-、NO3- | |
| C. | 含MnO4-的溶液中 H+、K+、Br-、I- | |
| D. | 在$\frac{c({H}^{+})}{c(O{H}^{-})}$=1×10-12的溶液中 Na+、K+、CH3COO-、SO42- |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | Fe2O3跟稀硝酸反應 | B. | Al(OH)3跟稀硝酸反應 | ||
| C. | CuO跟稀硝酸反應 | D. | Fe(OH)2跟稀硝酸反應 |
查看答案和解析>>
湖北省互聯(lián)網(wǎng)違法和不良信息舉報平臺 | 網(wǎng)上有害信息舉報專區(qū) | 電信詐騙舉報專區(qū) | 涉歷史虛無主義有害信息舉報專區(qū) | 涉企侵權(quán)舉報專區(qū)
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com