
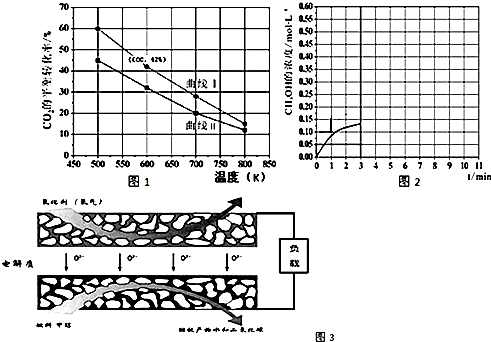
分析 (1)依據熱化學方程式和蓋斯定律計算得到所需熱化學方程式,反應自發進行的判斷依據是△H-T△S<0;
(2)①圖象分析相同溫度下,兩種反應物,增大一種物質的量會提高另一種物質的轉化率;
②a.結合三行式進行計算,化學反應的平衡常數K各個生成物平衡濃度系數次方的乘積和各個反應物平衡濃度系數次方乘積的比值,據此計算;
b.3min時未到達平衡,此時迅速將體系溫度升至600K,瞬間甲醇的濃度不變,反應速率加快,到達平衡的時間小于10min,而在溫度為600K的條件下,充入3mol H2和1.5mol CO2,平衡時二氧化碳的轉化率約是42%,則平衡時甲醇的物質的量約是1.5mol×42%=0.63mol,則平衡時甲醇的濃度約是0.21mol/L;
(3)①以固體氧化鋯氧化釔為電解質,這種固體電解質在高溫下允許氧離子(O2-)在其間通過,分析該電池的工作原理如圖3所示可知負極是甲烷失電子發生氧化反應,結合導電離子和電荷守恒分析書寫;
②依據電極反應計算轉移電子物質的量.
解答 解:(1)反應Ⅰ:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H1=-49.58kJ•mol-1
反應Ⅱ:CO2(g)+H2(g)?CO (g)+H2O(g)△H2
反應Ⅲ:CO(g)+2H2(g)?CH3OH(g)△H3=-90.77kJ•mol-1
根據蓋斯定律,反應Ⅱ可以是Ⅰ-Ⅲ得到,所以反應Ⅱ的焓變△H2=(-49.58kJ•mol-1)-(-90.77kJ•mol-1)=+41.19 kJ•mol-1;根據反應自發行的判據:△H-T△S<0,反應Ⅲ是熵減的放熱的反應,所以要自發進行需要在較低溫下進行,
故答案為:+41.19 kJ•mol-1;較低溫;
(2)①A:n(H2)=3mol,n(CO2)=1.5mol,B:n(H2)=3mol,n(CO2)=2mol,二者比較B相當于增大二氧化碳的量,轉化率小于A,所以曲線 I代表A的投料,
故答案為:A;
②在溫度為500K的條件下,充入3mol H2和1.5mol CO2,該反應10min時達到平衡,二氧化碳的轉化率是60%,
CO2(g)+3H2(g)?CH3OH(g)+H2O(g)
初始濃度:0.5 1 0 0
變化濃度:0.3 0.9 0.3 0.3
平衡濃度:0.2 0.1 0.3 0.3
a.該溫度下,反應I的平衡常數K=$\frac{0.3×0.3}{0.2×0.{1}^{3}}$=450,
500K時,若在此容器中開始充入0.3molH2和0.9mol CO2、0.6molCH3OH、xmolH2O,濃度分別為0.1mol/L,0.3mol/L,0.2mol/L,$\frac{x}{3}$mol/L
若使反應在開始時正向進行,濃度商Qc=$\frac{0.2×\frac{x}{3}}{0.3×0.{1}^{3}}$<K=450
x=2.025
則x應滿足的條件是0<x<2.025
故答案為:450;0<x<2.025;
b.當反應時間達到3min時,迅速將體系溫度升至600K,則平衡正向進行,甲醇的濃度會增加,3min時未到達平衡,此時迅速將體系溫度升至600K,瞬間甲醇的濃度不變,反應速率加快,到達平衡的時間小于10min,而在溫度為600K的條件下,充入3mol H2和1.5mol CO2,平衡時二氧化碳的轉化率約是42%,則平衡時甲醇的物質的量約是1.5mol×42%=0.63mol,則平衡時甲醇的濃度約是0.21mol/L,3~10min內容器中CH3OH濃度的變化趨勢曲線為:圖象為,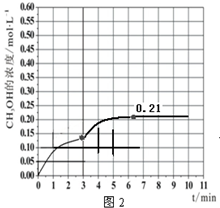 ,
,
故答案為: ;
;
(3)①以固體氧化鋯氧化釔為電解質,這種固體電解質在高溫下允許氧離子(O2-)在其間通過,分析該電池的工作原理如圖3所示可知負極是甲烷失電子發生氧化反應,結合導電離子和電荷守恒分析書寫電極反應為:CH3OH-6e-+3O2-=CO2↑+2H2O,
故答案為:CH3OH-6e-+3O2-=CO2↑+2H2O;
②16g甲醇物質的量=$\frac{16g}{32g/mol}$=0.5mol,發生反應時電子轉移0.5mol×6=3mol,
故答案為:3.
點評 本題綜合考查學生蓋斯定律的應用、化學反應速率的計算、化學平衡移動的影響因素等知識,屬于綜合知識的考查,難度較大.


 小博士期末闖關100分系列答案
小博士期末闖關100分系列答案 名校名師培優作業本加核心試卷系列答案
名校名師培優作業本加核心試卷系列答案科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 12C、13C和14C互為同位素,他們的放射性可用于考古斷代,可測定生物體死亡的年代 | |
| B. | 合成纖維是利用自然界的纖維材料通過化學合成方法得到的 | |
| C. | 研制出性能優良的催化劑可以使反應的溫度降低,從而起到很好的節能效果 | |
| D. | 碰撞理論和過度態理論是常用的化學反應速率理論,其中過渡態理論可解釋溫度、濃度等對化學反應速率的影響 |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 滴定管用蒸餾水洗滌后,裝入NaOH溶液進行滴定 | |
| B. | 滴定達到終點時,發現滴定管尖嘴部分有懸滴,則測定結果偏小 | |
| C. | 用酚酞作指示劑,當錐形瓶中溶液由紅色變無色時停止滴定 | |
| D. | 隨著NaOH溶液的滴入,錐形瓶中的pH由小變大 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 3.65g | B. | 7.3g | C. | 10.95g | D. | 14.6g |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 4、1、5、NO2 | B. | 4、2、4、NO2 | C. | 4、1、3、NH4NO3 | D. | 4、3、5、NO |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 加入稀鹽酸產生無色氣體,將氣體通入澄清石灰水中,溶液變渾濁,一定有CO32- | |
| B. | 加入氯化鋇溶液有白色沉淀產生,再加鹽酸,沉淀不消失,一定有SO42- | |
| C. | 加入碳酸鈉溶液產生白色沉淀,再加鹽酸白色沉淀消失,一定有Ba2+ | |
| D. | 加入氫氧化鈉溶液并加熱,產生的氣體能使濕潤紅色石蕊試紙變藍,一定有NH4+ |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com