
| 沉淀 | Cu(OH)2 | Al(OH)3 | Fe(OH)3 | Fe(OH)2 |
| 開始沉淀pH | 5.4 | 4.0 | 2.2 | 5.8 |
| 沉淀完成pH | 6.7 | 5.2 | 3.2 | 8.8 |
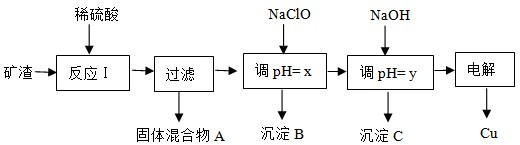
分析 礦渣加入稀硫酸,Cu2O、Al2O3、Fe2O3溶解,二氧化硅不溶,所以固體混合物A是不溶于稀硫酸的物質,發生的反應有Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;
由于單質Cu存在,鐵元素以Fe2+形式存在,反應方程式:2Fe3++Cu=Cu2++2Fe2+,濾液中主要是Al3+、Fe2+、Cu2+;
加入NaClO具有氧化性,氧化Fe2+為Fe3+,同時調節溶液pH使Al3+、Fe3+沉淀完全,根據Fe(OH)3和Al(OH)3開始沉淀和沉淀結束的pH關系,x范圍是:3.2≤pH<4.0,目的是沉淀Fe(OH)3;y范圍是:5.2≤pH<5.4,沉淀Al(OH)3;最后得到氯化銅、硫酸銅溶液,電解法獲取Cu時,陰極發生還原反應:Cu2++2e-=Cu;陽極發生氧化反應:2Cl--2e-=Cl2↑;次氯酸鈉中的次氯酸根結合溶液中的氫離子,PH升高;NaClO能調節pH的主要原因是由于發生反應ClO-+H+?HClO,ClO-消耗H+,從而達到調節pH的目的;溶液顯示酸性,次氯酸是弱酸,次氯酸根結合酸溶液中的氫離子;生成一種具有漂白作用的物質是次氯酸;
(1)固體混合物A中的成分是SiO2、Cu;
(2)反應I完成后,鐵元素的存在形式為Fe2+;
(3)通過以上分析知,y的數值范圍是5.2≤pH<5.4;
(4)根據Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=Cu2++2Fe2+知,Cu2O中大多數Cu元素生成銅離子,少數生成Cu單質,若電解法獲得Cu 64.0g,其物質的量是1mol,則原礦渣中Cu2O的物質的量大于0.5mol;
(5)ClO-和H+反應生成弱電解質HClO,從而消耗氫離子導致溶液pH升高;
(6)用NaClO調pH,生成沉淀B的同時生成一種具有漂白作用的物質,沉淀B是氫氧化鐵,漂白性物質是HClO,且該物質與還原產物的物質的量之比為4:1,據此書寫該反應的離子方程式.
解答 解:礦渣加入稀硫酸,Cu2O、Al2O3、Fe2O3溶解,二氧化硅不溶,所以固體混合物A是不溶于稀硫酸的物質,發生的反應有Cu2O+2H+=Cu+Cu2++H2O,得出A的成分是SiO2、Cu;
由于單質Cu存在,鐵元素以Fe2+形式存在,反應方程式:2Fe3++Cu=Cu2++2Fe2+,濾液中主要是Al3+、Fe2+、Cu2+;
加入NaClO具有氧化性,氧化Fe2+為Fe3+,同時調節溶液pH使Al3+、Fe3+沉淀完全,根據Fe(OH)3和Al(OH)3開始沉淀和沉淀結束的pH關系,x范圍是:3.2≤pH<4.0,目的是沉淀Fe(OH)3;y范圍是:5.2≤pH<5.4,沉淀Al(OH)3;最后得到氯化銅、硫酸銅溶液,電解法獲取Cu時,陰極發生還原反應:Cu2++2e-=Cu;陽極發生氧化反應:2Cl--2e-=Cl2↑;次氯酸鈉中的次氯酸根結合溶液中的氫離子,PH升高;NaClO能調節pH的主要原因是由于發生反應ClO-+H+?HClO,ClO-消耗H+,從而達到調節pH的目的;溶液顯示酸性,次氯酸是弱酸,次氯酸根結合酸溶液中的氫離子;生成一種具有漂白作用的物質是次氯酸;
(1)通過以上分析知,固體混合物A中的成分是SiO2、Cu,故答案為:SiO2、Cu;
(2)反應I發生的反應為Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=Cu2++2Fe2+,所以反應I完成后,鐵元素的存在形式為Fe2+,故答案為:Fe2+;
(3)通過以上分析知,調節y的目的是除去鋁離子而不能除去銅離子,所以y的數值范圍是5.2≤pH<5.4,故答案為:5.2≤pH<5.4;
(4)根據Cu2O+2H+=Cu+Cu2++H2O、2Fe3++Cu=Cu2++2Fe2+知,Cu2O中大多數Cu元素生成銅離子,少數生成Cu單質,若電解法獲得Cu 64.0g,其物質的量是1mol,原礦渣中Cu2O的物質的量大于0.5mol而小于1mol,其質量=0.5mol×144g/mol=72g,所以大于72g而小于144g,故答案為:c;
(5)ClO-和H+反應生成弱電解質HClO,從而消耗氫離子導致溶液pH升高,從而調節溶液的pH,故答案為:b;
(6)用NaClO調pH,生成沉淀B的同時生成一種具有漂白作用的物質,沉淀B是氫氧化鐵,漂白性物質是HClO,且該物質與還原產物的物質的量之比為4:1,據此書寫該反應的離子方程式為2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO,
故答案為:2Fe2++5ClO-+5H2O=2Fe(OH)3+Cl-+4HClO.
點評 本題考查物質分離和提純,為高頻考點,涉及氧化還原反應、離子方程式的書寫、基本操作、pH判斷等知識點,明確反應原理及基本操作方法是解本題關鍵,難點是判斷調節溶液的pH,題目難度不大.


科目:高中化學 來源: 題型:解答題

查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | B. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | ||
| C. | c(Cl-)=c(NH4+)>c(OH-)=c(H+) | D. | c(Cl-)=c(NH4+)>c(OH-)>c(H+) |
查看答案和解析>>
科目:高中化學 來源: 題型:解答題
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 反應過程中可以看到白色沉淀先轉化為灰綠色后轉化為紅褐色 | |
| B. | 若Fe2+失去4mol電子,生成氧氣的體積在標準狀況下約為22.4L | |
| C. | 4 mol Na2O2在反應中共得到6NA個電子 | |
| D. | 該反應中Na2O2既是氧化劑又是還原劑,O2是氧化產物 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 該溶液物質的量濃度為10moL/L | |
| B. | 所得的溶液的體積為22.5L | |
| C. | 該溶液中溶質的質量分數因溶液的密度未知而無法求得 | |
| D. | 根據題干數據,該溶液物質的量濃度無法求得 |
查看答案和解析>>
科目:高中化學 來源: 題型:選擇題
| A. | 1L 0.3mol•L-1的Na2SO4溶液 | B. | 4L 0.5mol•L-1的NaCl溶液 | ||
| C. | 2L 0.3mol•L-1的NaOH的溶液 | D. | 1L 0.15mol•L-1的Na3PO4的溶液 |
查看答案和解析>>
湖北省互聯網違法和不良信息舉報平臺 | 網上有害信息舉報專區 | 電信詐騙舉報專區 | 涉歷史虛無主義有害信息舉報專區 | 涉企侵權舉報專區
違法和不良信息舉報電話:027-86699610 舉報郵箱:58377363@163.com