實驗探究NO
2的性質(zhì).
已知:2N0
2+2Na0H=NaNO
3+NaNO
2+H
2O.
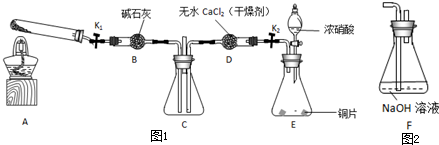
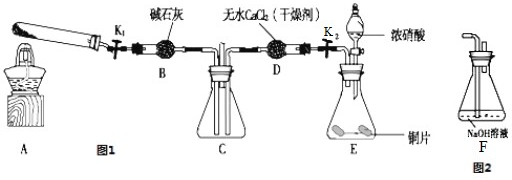
任務(wù)1:利用如圖所示裝置探究NO
2能否被NH
3還原(K
1、K
2為止水夾;夾持固定裝置略去).
(1)A中發(fā)生反應(yīng)的化學(xué)方程式是
.由裝置E制取NO
2,其中藥品a的名稱是
,為控制緩慢生成NO
2速率,藥品b應(yīng)選用
狀固體.
(2)若NO
2能夠被NH
3還原,預(yù)期觀察到C裝置中的現(xiàn)象是
.
(3)實驗過程中,未能觀察到C裝置中的預(yù)期現(xiàn)象.該小組同學(xué)從反應(yīng)原理的角度分析了原因,認(rèn)為可能是
①NH
3還原性較弱,不能將NO
2還原;
②在此條件下,NO
2的轉(zhuǎn)化率
;
③在此條件下,該反應(yīng)的
.
(4)此實驗裝置存在一個明顯的缺陷,應(yīng)該添加
裝置.
任務(wù)2:探究NO
2能否與Na
2O
2發(fā)生氧化還原反應(yīng).
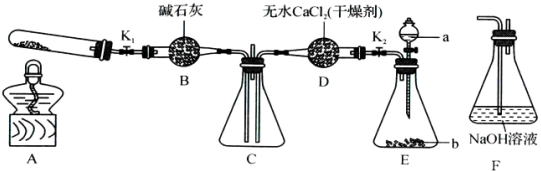
(5)實驗前,該小組同學(xué)提出三種假設(shè),其中之一為假設(shè)NO
2能被Na
2O
2氧化.為了驗證這一假設(shè),該小組同學(xué)選用任務(wù)1中的B、D、E裝置,將B中的藥品更換為Na
2O
2,另選F裝置(如下圖所示),重新組裝,進(jìn)行實驗.
①裝置的合理連接順序:E
(某些裝置可以重復(fù)使用);
②實驗過程中,B裝置中淡黃色粉末逐漸變成白色,經(jīng)檢驗,該白色物質(zhì)為純凈物,且無其他物質(zhì)生成,推測B裝置中生成物為
.




 陽光課堂同步練習(xí)系列答案
陽光課堂同步練習(xí)系列答案